在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按下图连接。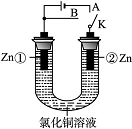
(1)如果把电键K接A,该装置应是________,Zn①为________极,Zn②的电极反应为________________。
(2)上述反应进行5 min后,转换电键K到B,则这一装置是________,Zn②为________极,Zn①的电极反应式是____________________。
(3)将Zn②换成铁片,电解质溶液换成ZnCl2饱和溶液,K接A,此时该装置为______池,阴极电极反应式为____________________________。
在医疗上常使用一种热敷袋,袋内盛装的主要成分是:铁屑、碳粉、木屑、食盐、水等。热敷袋使用之前用塑料袋封装,使之与空气隔绝。使用时,打开塑料袋让空气进入,轻揉热敷袋,就会放出热量。使用完后,会发现袋内有许多铁锈生成。试填写下列空白:
(1)热敷袋放出的热量来源于_____________________________。
(2)铁屑、碳粉、食盐、水混合后,发生化学变化的原理是_____________________。
(3)写出使用热敷袋的过程中发生的电极反应式和有关的化学方程式:
负极:____________,正极:____________,总反应:___________________。
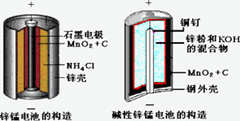
酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答问题
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
(1) 酸性锌锰干电池的负极反应为_________
(2) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式__________
(3) 维持电流强度为0.6A,电池工作10分钟,理论消耗Zn g。(结果保留到小数点后两位,F=96500C/mol)
(4) 用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:
①加入足量稀硫酸和_________溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为____到____之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀。
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。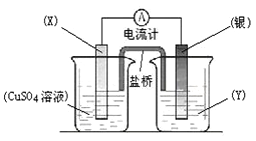
(1)电极X的材料是_____________;电解质溶液Y是_____________;
(2)银电极为电池的_________极,发生的电极反应为__________;X电极上发生的电极反应为__________;
(3)外电路中的电子是从__________电极流向_________电极(填电极材料的名称)。
运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O。电解质为KOH溶液,则负极反应式为______________________________。
(2)向BaCl2溶液中通CO2不会出现沉淀,因此某同学根据相同的理由认为向BaCl2溶液中通入SO2也不会出现沉淀,但在实验验证中发现了异常情况,将SO2通入BaCl2溶液中开始并无沉淀,放置一段时间出现了白色沉淀,则产生该沉淀的离子反应方程式为_ 。
(3)有人认为Mg、Si的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写):___________________。
工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32—(aq) PbCO3(s)+SO42—(aq)。
PbCO3(s)+SO42—(aq)。
Ksp (PbCO3)=1.5×10-13,Ksp (PbSO4)=1.8×10-8某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)计算上述反应的平衡常数:K= 。
(2)加入足量NaHCO3溶液也可实现该转化,写出离子方程式____________
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,
假设一:全部为2PbCO3·Pb(OH)2;
假设二:全部为PbCO3;
假设三:2PbCO3·Pb(OH)2和PbCO3的混合物
为验证假设一是否成立,课题组进行如下研究。
| 实验步骤 |
实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的洗气瓶。 |
无水硫酸铜变蓝色,澄清石灰水变浑浊 说明样品全部是2PbCO3·Pb(OH)2 |
①你是否同意该同学的结论,并简述理由 。
②如果不同意,请提出改进意见___________________________
氯铝电池是一种新型的燃料电池,电解质溶液是KOH溶液。试回答下列问题:
(1)通入氯气的电极是__________极(填“正”或“负”);
(2)铝电极是__________极(填“正”或“负”);
(3)电子从__________(填“Al”或“Cl2”,下同)电极流向__________的电极。
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
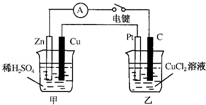
(1)甲装置的名称是 ;乙装置的名称是 ;Zn为 极;Pt为 极.
(2)写出电极反应式:Cu极 ;C极 .
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色 (填“变深”、“变浅”或“无变化”).
(4)若乙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将 (填“增大”、“减小”或“不变”,下同);乙中溶液的pH将 .
氰(CN)2的化学性质与卤素很相似(X2),称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。
(1)HCN分子中含有4个共价键,写出HCN的结构式:____________。
(2)KCN溶液显碱性,原因是____________(用离子方程式表示)。
(3)下列有关方程式不正确的是____________。
| A.(CN)2+2NaOH===NaCN+NaCNO+H2O |
| B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O |
| C.I2+2KCN===2KI+(CN)2 |
| D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2 |
(4)25℃,0.1mol/LKOH溶液和0.2mol/LHCN溶液等体积混合,若溶液最终PH=8,则c(CN-) c(HCN),原因是 。此溶液中c(CN-)与c(HCN)差值的数值为:
(5)已知HCN可以在氧气中燃烧成CO2、H2O和N2,由此原理可以设计酸性条件下原电池,书写其负极反应式: 。
下图是一个化学过程的示意图。

I.(1)图中甲池是________装置(填“电解池”或“原电池”),其中OH-移向________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:______________。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的反应式:______________________________。(注意:背后还有试题)
(4)乙池中总反应的离子方程式:____________________________________________。
II.氯碱工业中电解饱和食盐水的原理示意图如图所示。

(1)溶液A的溶质是 ________________________________ ;
(2)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。
精致流程如下(淡盐水和溶液A来自电解池):

①盐泥a除泥沙外,还含有的物质是 ___________________________ 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是 _______________________________。
③BaSO4的溶解度比BaCO3的小。过程Ⅱ中除去的离子有 _______________ 。
下列四个装置图均与电化学有关,请根据图示回答相关问题:
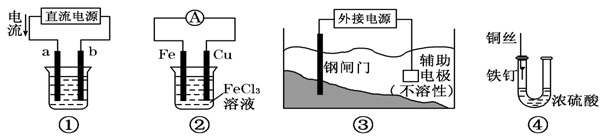
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图实验(图中所用电极均为惰性电极)

(1)电极a为 极(填“正”或“负”),溶液中OH-移向 极(填a或b);
(2)电极b处所发生的电极反应方程式为 ;[随着反应的进行,氢氧燃料电池内部溶液的PH将 (填“增大”或“减小”);
(3)c极为 (填“阴”或“阳”)极,d电极反应式为 ;
(4)右图装置中盛有100mL0.1mol·L-1AgNO3溶液,当装置工作时右装置中发生的总反应方程式 为 ;
(5)当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时右图装置中溶液的c(H+)= 。(溶液体积变化忽略不计)
(6)氢氧燃料电池的优点 ;
(1)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极反应式为________________。
②为了降低某水库的铁闸门被腐蚀的速率,可以采用如图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_________________。
| A.铜 | B.锡 | C.锌 | D.石墨 |
③如图乙方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的__________极上。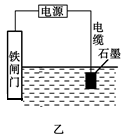
(2)根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示。
①电极Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为______________(填化学式)。
②电极Ⅱ发生的电极反应式为___________________。
(3)某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu。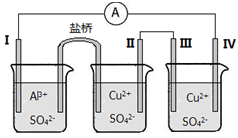
①电极Ⅰ为_________极(填“正”“负”或“阴”“阳”),发生___________反应(填“氧化”或“还原”),电极反应式为_______________;电极Ⅲ为_______________极(填“正”“负”或“阴”“阳”)。
②盐桥中盛有含KNO3溶液的琼脂,盐桥中的K+向_____________极(填“Ⅰ”或“Ⅱ”)移动。
写出下列反应的热化学方程式或电极反应式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量 。
(2)钢铁发生吸氧腐蚀时的正极电极反应式 。
(3)CH4与O2在酸性条件下形成原电池时,负极的电极反应式 。
铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸,工作时该电池的总反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。试根据上述情况判断:
(1)蓄电池的负极材料是______________________。
(2)工作时,正极反应为______________________。
(3)工作时,电解质溶液的酸性________(填“增大”“减小”或“不变”)。
(4)工作时,电解质溶液中阴离子移向________极。(填“正”或者“负”)
(5)电流方向从________极流向________极。(填“正”或者“负”)