铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3 大量地用于电镀工业中。
(1)在下图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体。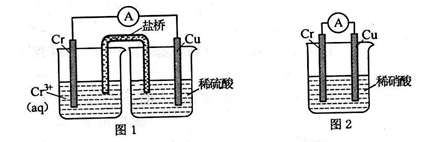
图 2 装置中铬电极的电极反应式______________________
(2)最近赣州酒驾检查特别严,利用 CrO3具有强氧化性,有机物(如酒精)遇到 CrO3时,猛烈反应,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸, 从而增强导电性,根据电流大小可自动换算出酒精含量。写出该反应的化学方程式为_________________________
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀, 利用右图装置,可以模拟铁的电化学防护。若 X 为碳棒,为 减缓铁的腐蚀,开关 K 应置于________处。若 X 为锌,开关K 置于________处。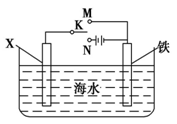
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的 主要原因。净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72-发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH-结合生成 Fe(OH)3和 Cr(OH)3沉淀除去【已知某条件下的KspFe (OH)3 = 3.0×10-31, KspCr(OH)3 = 6.0×10-38】。已知电解后的溶液中 c(Fe3+)为 2.0×10-6 mol·L1,则溶液中c(Cr3+)为______________mol·L-1。
下列四个装置图均与电化学有关,请根据图示回答相关问题:
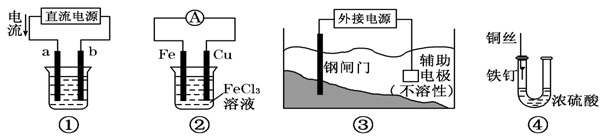
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
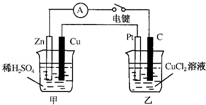
(1)甲装置的名称是 ;乙装置的名称是 ;Zn为 极;Pt为 极.
(2)写出电极反应式:Cu极 ;C极 .
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色 (填“变深”、“变浅”或“无变化”).
(4)若乙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将 (填“增大”、“减小”或“不变”,下同);乙中溶液的pH将 .
铁是用途最广泛的金属材料之一,但生铁易生锈,请讨论电化学实验中有关铁的性质。
(1)某原电池装置如图所示,右侧烧杯中的电极反应为_________,左侧烧杯中的c(Cl-)________(填“增大”“减小”或“不变”)。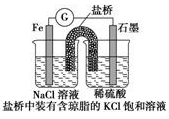
(2)已知下图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料(填“Fe”或“C”)。
(3)用高铁酸盐设计的高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极电极反应式________________________________。
②用高铁电池做电源,以铁为阳极,以铜作阴极,对足量KOH溶液进行电解,当电池中有0.2molK2FeO4反应时,则在电解池中生成H2________L。(标准状况)
(1)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极反应式为________________。
②为了降低某水库的铁闸门被腐蚀的速率,可以采用如图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_________________。
| A.铜 | B.锡 | C.锌 | D.石墨 |
③如图乙方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的__________极上。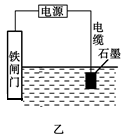
(2)根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示。
①电极Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为______________(填化学式)。
②电极Ⅱ发生的电极反应式为___________________。
(3)某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu。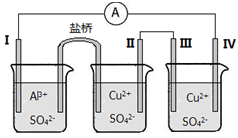
①电极Ⅰ为_________极(填“正”“负”或“阴”“阳”),发生___________反应(填“氧化”或“还原”),电极反应式为_______________;电极Ⅲ为_______________极(填“正”“负”或“阴”“阳”)。
②盐桥中盛有含KNO3溶液的琼脂,盐桥中的K+向_____________极(填“Ⅰ”或“Ⅱ”)移动。
仔细观察下图,根据题意对图中两极进行必要的连接后填空:
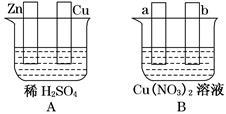
(1)若在图A中,使铜片上冒H2气泡。则加以必要的连接后的装置叫 。
(2)若在图B中,a、b为惰性电极,进行必要的连接后使b极析出1.28g铜,则a极析出的物质的物质的量为 ,反应的总反应方程式为 。
(3)若将图A中Zn、Cu两极与图B中a、b作必要的边接后,也能产生与(1)、(2)完全相同的现象,则Cu极连_______极(填a或b)。经过一段时间后,停止反应并搅匀溶液,图B中溶液的pH_________(填写“升高”、“降低”或“不变”),欲使溶液恢复至与反应前完全一致,则应加入的一定量的物质是_________。
| A.CuO | B.Cu(OH)2 | C.Cu2(OH)2CO3 | D.CuCO3 |
原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________池;
(2)下列反应能设计成原电池的是:
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HC1=NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。

钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:
2Mn2++5S2O82-+8H2O  2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的价电子排布式为 。
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为 (填元素符号)。
(3)已知H2S2O8的结构如图。
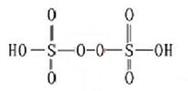
①H2S2O8硫原子的轨道杂化方式为 。
②上述反应中被还原的元素为 。
③上述反应每生成1 mol MnO4-,S2O82- 断裂的共价键类型及其数目为 、 。
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。

①右图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为 ;
②实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是 。
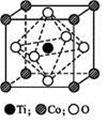
(5)MnO2可用于碱锰电池材料的正极材料,加入某种纳米粉体可以优化碱锰电池的性能,该纳米粉体的结构如右图。该纳米粉体的化学式为__________。
(6)铑(Rh)与钴属于同族元素,性质相似。铑的某配合物的化学式为CsRh(SO4)2·4H2O,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为 。
(1)工业上常用 CO2和 NH3通过如下反应合成尿素[CO(NH2)2]。
2NH3(g)+CO2(g)  CO(NH2)2(g)+H2O(g) △H<0
CO(NH2)2(g)+H2O(g) △H<0
t℃时,向容积恒定为 2L的密闭容器中加入 0.10 molCO2和 0.40 molNH3, 70 min 开始达到平衡。反应中 CO2 (g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
20 |
70 |
80 |
100 |
| n(CO2)/mol |
0.10 |
0.060 |
0.020 |
0.020 |
0.020 |
①70 min 时,平均反应速率 υ(CO2)= mol/(L·min)。
②在100 min时,保持其它条件不变,再向容器中充入0.050 mo1CO2和0.20 molNH3, 重新建立平衡后CO2的转化率与原平衡相比将___________(填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_________(保留一位小数)。
④下图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液 制取氢气。该装置中阳极的电极反应式为__________________。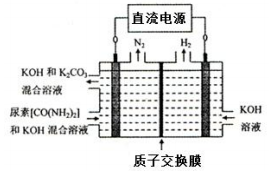
(2)CH4燃料电池,装置示意如图(A、B为多孔性碳棒)。
持续通入甲烷,在标准状况下,消耗甲烷体积VL。当0<V≤44.8 L 时,电池总反应方程式为______________。
Ⅰ.二氧化锰是化学工业中常用的氧化剂和催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3(s)+O2(g) 2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)
2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)  MnO(s) + CO2(g) ②2MnO(s) + O2(g)
MnO(s) + CO2(g) ②2MnO(s) + O2(g)  2MnO2(s)
2MnO2(s)
(1)反应①达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是 。(填字母序号)
| A.平衡常数减小 | B.MnCO3质量不变 | C.CO2压强不变 | D.MnCO3物质的量增加 |
(2)反应②在低温下能自发进行,则其△H 0(填“>”、“<”、“=”)。
(3)某温度下,该平衡体系的总压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,则碳酸锰热分解总反应的化学平衡常数Kp= (提示:用含P、n1、n2 的字母表达, 分压 = 总压×物质的量分数)
Ⅱ. 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的悬浊液与烟气中SO2反应可制备MnSO4·H2O。
(4)已知:Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =3×10‾39,pH =7.1时Mn(OH)2开始沉淀,pH =9.4时Mg(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+( 欲使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______________________。
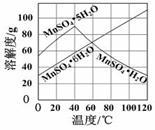
(5)由右图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为 Ⅰ. 。Ⅲ. 二氧化锰也是电化学的重要材料。
(6)碱性锌锰电池的总反应是:Zn + 2MnO2 + 2H2O ="=" 2MnOOH + Zn(OH)2,该电池正极的电极反应为 。
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸。请回答:
(1)氨气催化氧化的化学方程式为______________________。
(2)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2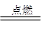 2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________。
2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________。
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为______________________。
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O Cu2O+H2↑,如图所示.该电解池的阳极反应式为______________________。
Cu2O+H2↑,如图所示.该电解池的阳极反应式为______________________。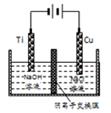
大气污染越来越成为人们关注的问题,工业生产尾气中的氮氧化物必须脱除(即脱硝)后才能排放。
(1)已知:
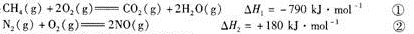
CH4可用于脱硝,其热化学方程式为:

已知反应①中的相关的化学键键能数据如下:

由此计算△H3= kJ·mol-1,C-H化学键键能E= kJ·mol-1。
(2)反应2CO(g) +2NO(g)=N2(g)+2CO2(g)也可用于脱硝,图1为该反应过程中NO的平衡转化率a(NO)与温度、压强的关系[其中初始c(CO)和c(NO)均为1mol.L-1],计算该反应在200cC时的平衡常数K=__ ,图中压强(P1、P2、P3)的大小顺序为_____________。

(3)有人利用电化学方法将CO和NO转化为无毒物质。装置如图2所示
①电极a是 极;②电极b的电极反应式是 。
(4)新型臭氧氧化技术利用具有极强氧化性的0,对尾气中的NO脱除,反应为NO(g)+O3(g)=NO2(g)+O2(g),在一定条件下,将NO和0,通人密闭容器中并不断加热发生反应(温度不超过各物质的分解温度),NO2的体积分数妒(NO2)随时间变化如图3所示,可以发现t1s后NO。的体积分数下降,其可能的原因是__________。研究小组通过增大 比值提高NO的平衡转化率,却发现当
比值提高NO的平衡转化率,却发现当 >1时,NO2的物质的量减小,可能原因是________________。
>1时,NO2的物质的量减小,可能原因是________________。
下图是一个化学过程的示意图。
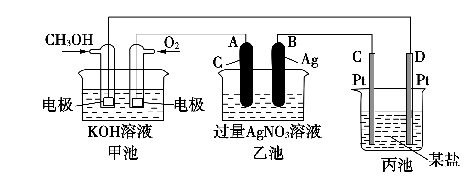
(1)通入O2的电极名称 、C(Pt)电极的名称是______________
(2)写出通入O2的电极上的电极反应式是_______ _______________________。
(3)写出通入CH3OH的电极上的电极反应式是______________________________。
(4)乙池中反应的化学方程式为__________________________________。
(5)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2__________mL(标准状况下);
S02的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大S02的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):

(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e所带电量为1.6×10-19C)。
Ⅱ,溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为 。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:

①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因 。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是 。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:

①写出阳极发生的电极反应式 ;
②当电极上有2 mol电子转移时阴极产物的质量为 。