中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。
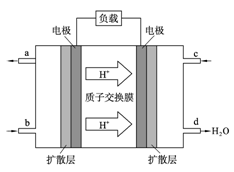
(1)该电池工作时,b口通入的物质为____________,c口通入的物质为__________。
(2)该电池负极的电极反应式为_________________。
(3)工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有__________NA个电子转移。
(4)若将a口排放出的1.12L气体,通入到5L0.015mol·L-1NaOH溶液中完全反应。反应后的溶液中离子浓度由大到小的顺序为 。
某学习小组依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
| |
SO2Cl2 |
Cl2 |
SO2 |
| 熔点/℃ |
–54.1 |
–101 |
–72.4 |
| 沸点/℃ |
69.1 |
–34.6 |
–10 |
| 性质 |
遇水发生剧烈水解 |
|
|
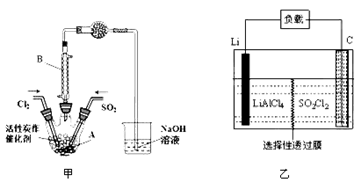
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,反应的离子方程式为______________;
(2)B仪器的作用是________________;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为____。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________________。
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li+SO2Cl2 = 2LiCl+SO2,则电池工作时,正极的电极反应式为__________________。
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是电化学过程的示意图。

已知甲池的总反应式为:2CH3OH+3O2+4KOH K2CO3+6H2O,请填空:
K2CO3+6H2O,请填空:
(1)充电时:①原电池的负极与电源______极相连,②阳极的电极反应为________。
(2)在此过程中若完全反应,乙池中B极的质量增加648g,则甲池中理论上消耗O2_______L(标准状况下)。
(3)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
A.Ag与空气中的氧气反应生成氧化银
B.Ag与空气中的含硫化合物反应生成硫化银
C.Ag与空气中氧及含硫化合物反应生成硫化银
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL 0.018mol·L-1的AgNO3溶液中加入50mL 0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)如图下所示原电池正极的反应式为 。

目前,市场上经常用甲醇碱性燃料电池做为手机的电池,该电池的储电量可长达一个月,非常适合通话量比较高的人群,请写出该燃料电池的正极电极反应: 和负极电极反应: 。
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式 。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)="2HCl" (g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol, E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: ; ②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为 ;

若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2 2Q1(填“>”、“<”或“=”)
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是_________________。
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为________________。
(3)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
原电池的正极__________(填“得到”或“失去”)电子,发生__________(填“氧化”或“还原”)反应;负极__________(填“得到”或“失去”)电子,发生__________(填“氧化”或“还原”)反应。
(1)原电池是一种把 转化为 的装置。
(2)铜-锌-稀硫酸电池中,负极的电极反应式是 。
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:

①图中X溶液是 ;
②石墨电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 (填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极; ②图丙中的②线是 的变化。
③当电子转移为2 mol时,向乙烧杯中加入 L 5 mol·L-1 NaOH溶液才能使Cu2+沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________;
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式________________________;
(3)已知H2O(l)=H2O(g) ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为________________________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________________________。
有如下两个反应: A 2HCl+Ba(OH)2===BaCl2+2H2O
B 2Fe3++Cu==2Fe2++Cu2+
(1)根据两反应的本质,判断能否设计成原电池:A B (填“能”或“不能”)不能设计成原电池的原因是
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是 ,正极材料是 ,电解质溶液是
②写出负极的电极反应式
③若导线上转移电子0.2mol,则负极质量变化是
原电池中发生的化学反应属于 ,原电池将 转化为 能。其中,电子流出的一极是原电池的 极,该极发生 反应,电子流入的一极是原电池的 极,该极发生 反应。原电池中电解质溶液的作用是 。