[吉林]2011-2012学年吉林省油田高中高一下学期期中考试化学试卷
19世纪中叶,对元素周期律有重大贡献的科学家是
| A.勒夏特列 | B.门捷列夫 | C.道尔顿 | D.拉瓦锡 |
下列化学用语正确的是:
| A.8个中子的碳原子的核素符号:12C | B.H2O的电子式: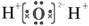 |
C.Cl-离子结构示意图: |
D.甲烷的结构式: |
某元素X 的气态氢化物的化学式为XH3,则X的最高价氧化物的水化物的化学式可能为
| A. H2XO3 | B. HXO3 | C. HXO | D. H2XO4 |
下列各组物质的性质比较中,正确的是
| A.稳定性:HCl>H2S>H2O | B.碱性:NaOH >KOH>Mg(OH)2 |
| C.酸性:HClO4>HBrO4>HIO4 | D.还原性:I-﹤Br -﹤Cl- |
已知X、Y、Z都是第三周期元素,且核电荷数依次增大,X的最高价氧化物对应水化物为强碱,Z的原子半径在第三周期(除稀有气体外)最小。据此判断下列说法不正确的是
| A.X是ⅠA元素,Z是VIIA元素 |
| B.X、Y、Z三种元素的最高化合价逐渐减小 |
| C.Z的最高价氧化物对应的水化物是强酸 |
| D.X、Z形成的化合物是离子化合物 |
下列各组化合物中,化学键类型完全相同的是
| A.CaCl2和 Na2S | B.Na2O 和Na2O2 | C.CO2和CaO | D.HCl和NaOH |
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
| X |
Y |
|
| |
Z |
W |
A.原子半径: W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.气态氢化物的稳定性:Z>W
D.W的单质能与水反应,生成一种具有漂白性的物质
元素性质呈周期性变化的决定因素是
| A.元素原子半径大小呈周期性变化 | B.元素的相对原子质量依次递增 |
| C.元素原子核外电子排布呈周期性变化 | D.元素的最高正化合价呈周期性变化 |
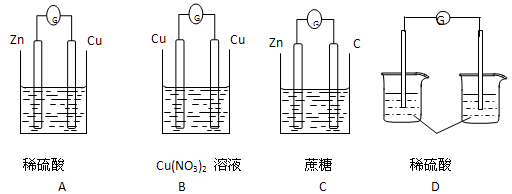
如图是氢氧燃料电池构造示意图。关于该电池的说法不正确的是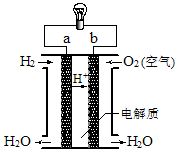
| A.a极是负极 |
| B.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
| C.电子由b通过灯泡流向a |
| D.氢氧燃料电池是环保电池 |
一学生欲通过实验判断X,Y,Z,W四块金属的活泼性, 做了如下实验并得结论:当X,Y组成原电池时,Y为负极;当Z,W组成原电池时,W为正极;W能将Y从其盐溶液中置换出来,据此可知它们的活泼性顺序是
| A.Z>W> X > Y | B. Z>W> Y>X | C. X>Y>W>Z | D. X>Y>Z>W |
下列说法中错误的是
| A.化学反应中的能量变化通常表现为热量的变化 |
| B.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
下列属于氧化还原反应,且为吸热反应的是
A. CaO+H2O Ca(OH)2 Ca(OH)2 |
B.C+H2O CO+H2 CO+H2 |
| C. 2Al+Fe2O3=====2Fe+Al2O3 | D.2NaOH+H2SO4===Na2SO4+2H2O |
25℃,101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量.下列表示该反应的热化学方程式中正确的是
| A.CH4O(l)+3/2O2(g) = CO2(g)+2H2O(l);△H= -725.8kJ/mol |
| B.2CH4O(l)+3O2(g)= 2CO2(g)+4H2O(l);△H= +1451.6kJ/mol |
| C.2CH4O+O2 = 2CO2+4H2O(l);△H= -22.68kJ/mol |
| D. CH4O(l)+3/2O2(g) = CO2(g)+2H2O(g);△H= -725.8kJ/mol |
若甲烷与氯气以物质的量之比1:3混合,在光照下得到的有机产物:⑴CH3Cl,⑵CH2Cl2,⑶CHCl3,⑷CCl4,其中正确的是
| A.只有⑴ | B.只有⑶ | C.只有⑴⑵⑶ | D.⑴⑵⑶⑷都有 |
下列属于加成反应的是
A己烯使酸性高锰酸钾溶液褪色。
B、将苯滴入溴水中,振荡后水层接近五色。
C、乙烯使溴水褪色。
D、甲烷与氯气混合光照一段时间后黄绿色消失。
关于苯的说法正确的是
| A.苯使溴水褪色是因为发生了取代反应 |
| B.苯中各原子均在同一平面. |
| C.苯中没有典型的碳碳双键,所以不能发生加成反应. |
| D.苯中的含碳量高,燃烧时产生大量的黑烟. |
下列说法正确的是
| A.碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 |
| B.分子组成符合CnH2n+2的烃一定是烷烃 |
| C.正戊烷分子中所有原子均在一条直线上 |
| D.碳氢原子个数比为1:3的烃有2种 |
某烷烃只能生成一种一氯代物,此烷烃的分子式可以是
| A.CH4 | B.C3H8 | C.C4H10 | D.C6H14 |
反应4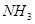 (气)+5
(气)+5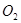 (气)
(气)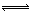 4NO(气)+6
4NO(气)+6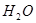 (气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率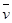 (X)(反应物的消耗速率或产物的生成速率)可表示为
(X)(反应物的消耗速率或产物的生成速率)可表示为
A.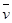 (NH3)=0.0100mol.L-1.s-1 (NH3)=0.0100mol.L-1.s-1 |
B.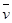 (O2)=0.0010mol.L-1.S-1 (O2)=0.0010mol.L-1.S-1 |
C.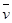 (NO)=0.0010mol.L-1.s-1 (NO)=0.0010mol.L-1.s-1 |
D.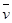 (H2O)=0.045mol.L-1.s-1 (H2O)=0.045mol.L-1.s-1 |
在一定条件下,反应A2(g)+B2(g) 2AB(g),达到反应限度的标志是
2AB(g),达到反应限度的标志是
| A.容器内气体的总压强不随时间的变化而变化 |
| B.单位时间内有nmolA2生成,同时就有nmolB2生成 |
| C.单位时间内有nmolA2生成,同时就有2nmolAB生成 |
| D.单位时间内有nmolB2生成,同时就有2nmolAB分解 |
一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是:
| A.达到化学反应平衡时,生成的NH3为2mol |
| B.达到化学反应平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学反应平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学反应平衡时,正反应和逆反应的速率都为零 |
在反应:C+CO2=2CO中,可使反应速率增大的措施是
①增大压强(缩小体积) ②升高温度 ③通入CO2(体积不变)④增加碳的量 ⑤降低压强
| A.①②③ | B.②③④⑤ | C.①②③④ | D.②③④ |
将4molA气体和2molB气体在2L容器中混合并在一定条件下发生下列反应:2A (g) + B(g)  2C(g) 若2秒钟后测得C的浓度为0.6mol.L-1,则下列说法正确的是
2C(g) 若2秒钟后测得C的浓度为0.6mol.L-1,则下列说法正确的是
| A.用物质A表示的反应平均速率为0.6mol.L-1.S-1 |
| B.用物质B表示的反应平均速率为0.6mol.L-1.S-1 |
| C. 2秒钟时,物质A的转化率为70% |
| D. 2秒钟时,物质B的转化率为30% |
有如下两个反应: A 2HCl+Ba(OH)2===BaCl2+2H2O
B 2Fe3++Cu==2Fe2++Cu2+
(1)根据两反应的本质,判断能否设计成原电池:A B (填“能”或“不能”)不能设计成原电池的原因是
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是 ,正极材料是 ,电解质溶液是
②写出负极的电极反应式
③若导线上转移电子0.2mol,则负极质量变化是
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。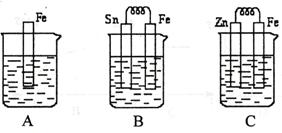
(1)A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH(填“增大”、“减小”或“不变”) 。
(3)C中被腐蚀的金属是 ,总反应方程式
0.1 mol某液态烷烃完全燃烧需要消耗0.8 mol 氧气,写出符合该物质化学式的烷烃的结构简式并写出每种物质系统命名的名称
写出下列反应的化学反应方程式,并判断其反应类型。
①乙烯与氯化氢反应: ,属于 反应;
②由苯制取溴苯: ,属于 反应;
某实验小组设计用50 mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在下图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热
数值 (填偏高、偏低或不变);
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
| 实验序号 |
起始温度t1/℃ |
终止温度(t2)℃ |
温差(t2-t1)℃ |
||
| 盐酸 |
NaOH溶液 |
平均值 |
|||
| 1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
| 2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
| 3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18J(g.·℃)则该反应的中和热为△H=___________________________________;
(3)若用浓硫酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因是 ;
阅读下列文字,填写文中带圈的数字后面的空白:
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。
(一)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:① ;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:②
(二)该同学取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
1.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
2.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验1中③ ,实验2中④ ,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,原因是_________ 。
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式 。
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______△H1(填“大于”、“小于”或“等于”),原因是 。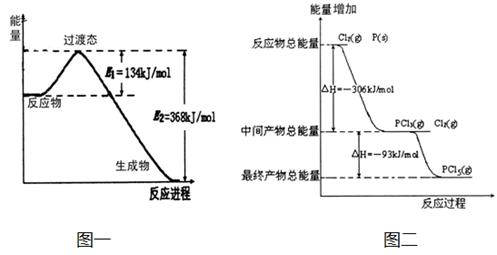
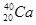 和
和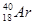

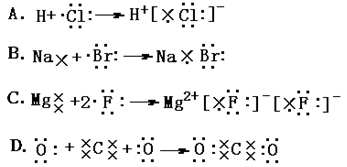
 粤公网安备 44130202000953号
粤公网安备 44130202000953号