下列说法中正确的是
| A.原电池是把电能转变为化学能的装置 |
| B.原电池中电子流出的一极是负极,发生氧化反应 |
| C.原电池的两极发生的反应均为氧化还原反应 |
| D.形成原电池后,原电池中的阳离子向负极方向移动 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
| A.电流由O2所在的铂电极流出 |
| B.该电池的负极反应式为:CH3CH2OH+3H2O -12e-=2CO2↑+12H+ |
| C.O2所在的铂电极处发生还原反应 |
| D.微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
右图为某种乙醇燃料电池示意图,工作时电子流方向如图所示,下列判断正确的是
| A.X为氧气 |
| B.电极A反应式:CH3CH2OH-12e-+3H2O=2CO2+12H+ |
| C.电极材料活泼性:A>B |
| D.B电极附近溶液pH增大 |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。RFC工作原理如图所示,下列有关说法正确的是
A.当有0.1mol电子转移时,a电极产生2.24LH2
B.b极上发生的电极反应是:4H2O+4e- =2H2↑+4OH-
C.c极上进行还原反应,B池中的H+可以通过隔膜进入A 池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源, 选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是

| A.电解过程中,c电极表面先有红色物质析出,后有气泡产生 |
| B.外电路中电子由c电极流向VB2电极 |
| C.VB2电极发生的电极反应为: 2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| D.若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通入甲烷和氧气而构成燃料电池。该电池中反应的化学方程式为CH4+2O2+2KOH K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是 (已知1个电子所带电量为1.6×10-19C)
K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是 (已知1个电子所带电量为1.6×10-19C)
A.通入甲烷的电极为电池的负极,通入氧气的电极为正极
B.在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量
C.通入甲烷电极的电极反应为:CH4+10OH--8e- CO32-+7H2O
CO32-+7H2O
D.放电一段时间后,溶液的pH减小
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如右。该电池工作时,下列说法正确的是( )
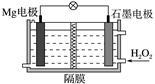
| A.Mg电极是该电池的正极 |
| B.H2O2在石墨电极上发生氧化反应 |
| C.石墨电极附近溶液的pH增大 |
| D.溶液中Cl-向正极移动 |
关于如图所示的原电池,下列说法正确的是( )
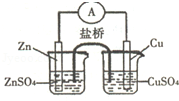
| A.电子从锌电极通过电流表流向铜电极 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.取出盐桥后,电流计的指针仍发生偏转 |
| D.铜电极上发生的电极反应是2H++2e﹣═H2↑ |
关于下列各装置图的叙述中,正确的是
| A.实验室用装置①制取氨气 |
| B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| C.装置③可用于制备氢氧化亚铁并观察其颜色 |
| D.装置④左侧烧杯中c(Cl-)减小 |
原电池是将化学能转变为电能的装置,关于如图所示原电池的说法正确的是( )

| A.Cu为负极,Zn为正极 |
| B.电子由铜片通过导线流向锌片 |
| C.正极反应式为Zn﹣2e﹣═Zn2+ |
| D.原电池的反应本质是氧化还原反应 |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
| A.正极反应式:Ca+2Cl--2e-=CaCl2 |
| B.放电过程中,Li+向负极移动 |
| C.常温时,在正负极间接上电流表或检流计,指针发生偏转 |
| D.每转移0.1 mol电子,理论上生成10.35 g Pb |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
| A.正极反应式:Ca+2Cl--2e-=CaCl2 |
| B.放电过程中,Li+向负极移动 |
| C.常温时,在正负极间接上电流表或检流计,指针发生偏转 |
| D.每转移0.1 mol电子,理论上生成10.35 g Pb |
某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
| A.该装置将化学能转化为光能和电能 |
| B.该装置工作时,H+从a极区向b极区迁移 |
| C.每生成1 mol O2,有44 g CO2被还原 |
| D.a电极的反应为:3CO2+ 18H++18e-=C3H8O+5H2O |