如图所示,甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O。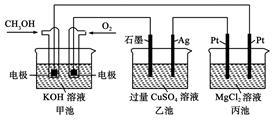
下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置 |
| B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上产生1.45 g固体 |
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是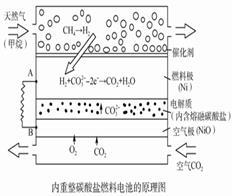
| A.以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解 |
| B.若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O |
| C.该电池使用过程中需补充Li2CO3和K2CO3 |
| D.空气极发生的电极反应式为O2+4e-+2CO2===2CO32- |
关于下列各装置图的叙述中,正确的是
| A.用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的正极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
有关下列四个常用电化学装置的叙述中正确的是( )

A.图Ⅰ所示电池中,负极电极反应为Zn-2e- Zn2+ Zn2+ |
| B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大 |
| C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 |
| D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag |
下列四种装置中,溶液的体积均为250毫升,开始时电解质溶液的浓度均为0.10摩/升,工作一段时间后,测得导线上均通过0.02摩电子,若不考虑溶液体积的变化,则下列叙述正确的是
| A.工作一段时间后溶液的浓度①=②=③=④ |
| B.工作一段时间后溶液的pH:④>③>①>② |
| C.产生气体的总体积:④>③>①>② |
| D.电极上析出的固体的质量:①>②>③>④ |
目前,科学家正在研究开发一种高能电池——钠硫电池,它以熔融钠、硫为两极,以导电的β—Al2O3陶瓷作固体电解质,反应式如下:2Na+xS  Na2Sx,以下说法正确的是
Na2Sx,以下说法正确的是
| A.放电时,Na作正极,S极发生还原反应 |
| B.充电时,钠极与外电源的正极相连 |
C.放电时,阳极发生的反应为:S -2e=xS -2e=xS |
| D.若用此电池电解AgNO3溶液,当阳极产生标准状况下的气体1.12L时,消耗的金属钠为4.6g |
下列用来表示物质变化的化学用语中,错误的是
| A.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| B.粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2+ +2e- =Cu |
C.用Pt电极电解氯化铝溶液:2Cl-+2 H2O  Cl2↑+H2+2OH- Cl2↑+H2+2OH- |
| D.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
在通风橱中进行下列实验:
| 步骤 |
 |
 |
|
| 现象 |
Fe表面产生大量无色气泡,液面上方变为红棕色 |
Fe表面产生少量红棕色气泡后,迅速停止 |
Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A.Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2==2NO2
B.进一步反应对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
C.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由强到弱的顺序是
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
纽扣式银锌电池的构造如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是
| A.Zn作负极 |
| B.电子经外电路流向Ag2O极 |
| C.K+向Zn极移动 |
| D.正极反应:Ag2O+H2O+2e-=2Ag+2OH- |
已知反应Cu(s) + 2Ag+ (aq) = Cu2+(aq) + 2Ag (s)为一自发进行的氧化还原反应,将其设计成如图所示原电池。下列说法中正确的是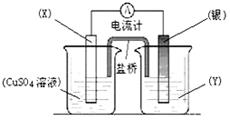
| A.银电极质量逐渐减小,Y溶液中c(Ag+)增大 |
| B.实验过程中取出盐桥,原电池仍继续工作 |
| C.电极X是正极,其电极反应为Cu-2e- = Cu2+ |
| D.当X电极质量减少0.64 g时,外电路中有0.02 mol电子转移 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是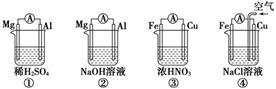
| A.①②中Mg作负极,③④中Fe作负极 |
| B.②中Mg作正极,电极反应式为:2H2O+2e-= 2OH-+H2↑ |
| C.③中Fe作负极,电极反应式为Fe-2e-= Fe2+ |
| D.④中Cu作正极,电极反应式为2H++2e-= H2↑ |
某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,能实现该反应的原电池是
| A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| B.正极为C,负极为Fe,电解质溶液为FeSO4溶液 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Cu,电解质溶液为CuSO4溶液 |
某兴趣小组同学利用氧化还原反应:
2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是
| A.a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O |
| B.外电路电子的流向是从a到b |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.b电极上发生还原反应 |