液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列关于该电池的叙述错误的是( )
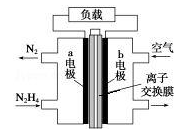
| A.b 极发生还原反应 | |
B.a 极的反应式为 N2H4﹣4e﹣═N2↑+4H+ |
C.放电时,电流从 b 极经过负载流向 a 极 |
| D.其中的离子交换膜需选用阴离子交换膜 |
如图所示,甲池的总反应式为 2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列说法正确的是( )
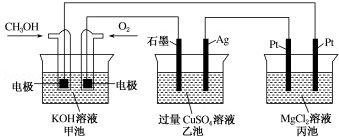
| A.若将乙池电解液换成 AgNO3 溶液,则可以实现在石墨棒上镀银 |
| B.甲池通入 CH3OH 的电极反应式为 CH3OH+6e﹣+2H2O═CO2-3+8H+ |
| C.反应一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4 溶液恢复到 原浓度 |
| D.甲池中消耗 224mL(标准状况下)O2,此时丙池中理论上产生 1.16g 固体 |
铜锌原电池(如图)工作时,下列叙述正确的是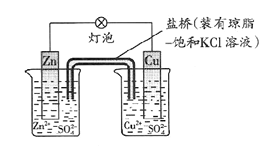
| A.一段时间后铜片增重,盐桥中K+移向CuSO4溶液 |
| B.正极反应为:Zn-2e-=Zn2+ |
| C.电子从铜片经导线流向锌片 |
| D.电池工作时Zn2+和Cu2+ 的浓度保持不变 |
下列反应中,不能形成原电池反应的是
| A.氢氧化钠与盐酸反应 | B.金属锌与稀硫酸反应 |
| C.甲烷燃烧 | D.金属铜溶于氯化铁溶液 |
下列关于电化学的理解正确的是
| A.原电池一定是负极材料失电子,发生氧化反应 |
| B.电解池的电极材料一定不参与电极反应 |
| C.原电池的负极和电解池的阳极一定发生氧化反应 |
| D.原电池中的阳离子移向负极,电解池中的阳离子则移向阴极 |
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:
LiFePO4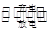 FePO4+Li,电池的正极材料是FePO4,负极材料是石墨和Li(Li嵌在石墨中),含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
FePO4+Li,电池的正极材料是FePO4,负极材料是石墨和Li(Li嵌在石墨中),含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
| A.可加入硫酸以提高电解质的导电性 |
| B.放电时电池内部Li+向负极移动 |
| C.充电过程中,电池正极材料的质量减少 |
| D.放电时电池负极反应为:FePO4+Li++e-= LiFePO4 |
有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)
| A.铜片上有气泡逸出 |
| B.反应中,盐桥中的K+会移向CuSO4溶液 |
| C.取出盐桥后,电流计依然发生偏转 |
| D.反应前后铜片质量不改变 |
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH﹣﹣2e﹣=ZnO+H2O;Ag2O+H2O+2e﹣=2Ag+2OH﹣
根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液的pH减小 |
| B.使用过程中,电子由Ag20极经外电路流向Zn极 |
| C.Zn是正极,Ag2O是负极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是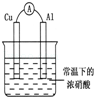
| A.Cu是原电池的负极 |
| B.Al是原电池的负极 |
| C.电子由Al沿导线流向铜 |
| D.铝片上的电极反应式为:Al﹣3e﹣═AL3+ |
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极.X、Y、Z三种金属的活动性顺序为
| A.X>Y>Z | B.X>Z>Y | C.Y>X>Z | D.Y>Z>X |
某同学设计了如图所示的盐桥式原电池,下列说法正确的是( )

| A.X若为Fe、Y可以为Na2SO4溶液 |
| B.X若为Cu、Y可以为AgNO3溶液 |
| C.电子由X电极经盐桥流向Ag电极 |
| D.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 |
下列有关说法正确的是( )
| A.燃料电池工作时,燃料在负极被还原 |
| B.氯碱工业采用的是以铜为电极,阳离子交换膜来电解饱和食盐水 |
C. 有Mg、Al和NaOH溶液组成的原电池,其负极为铝,电极反应为Al-3e- = Al3+ 有Mg、Al和NaOH溶液组成的原电池,其负极为铝,电极反应为Al-3e- = Al3+ |
| D.二次电池充电时,电池负极连接到外接电源的负极 |
锌片和铜片用导线连接后插入稀硫酸中可构成原电池,从原电池角度判断铜片是
| A.正极 | B.负极 | C.阴极 | D.阳极 |
以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是
A.Mg片作负极,电极反应:Mg-2e-  Mg2+ Mg2+ |
B.Al片作负极,电极反应:Al+4OH- -3e-  AlO2- +2H2 O AlO2- +2H2 O |
| C.电子从Mg电极沿导线流向Al电极 |
| D.Al片上有气泡产生 |