常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图。下列说法正确的是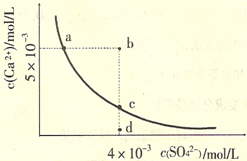
| A.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42-)对应曲线上任意一点 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L |
| C.d点溶液通过蒸发可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
在25℃时,有100g饱和Ca(OH)2溶液,向其中加入纯CaO粉末a g,反应后温度恢复到25℃,下列有关该溶液的说法正确的是
| A.溶液中c(Ca2+)将增大 | B.溶液的pH将增大 |
| C.溶液中Ca2+总数将减少 | D.溶液中c(OH-)减小 |
下列有关说法正确的是
| A.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
| B.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
C.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变升高温度,平衡时氢气转化率增大 2NH3(g) ΔH<0,其他条件不变升高温度,平衡时氢气转化率增大 |
| D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS<0 |
已知常温下,KSP(AgCl)=1.8×10-10 mol2·L-2,KSP(AgI)=8.3×10-17mol2·L-2,下列叙述中, 正确的是( )
| A.常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 |
| B.向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 |
| C.将 0.001 mol·L-1的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 |
| D.向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) |
中学化学涉及多种常数,下列说法正确的是
| A.对于合成氨反应,只要温度恒定,不论化学方程式怎样书写,平衡常数不变 |
B.某温度下,2L密闭容器中加入4 mol a和2 mol b发生反应:3A(g)+2B(g) 4C(1)+2D(g),则该反应的化学平衡常数表达式为 4C(1)+2D(g),则该反应的化学平衡常数表达式为 |
| C.室温下向一定量的稀氨水中加入水稀释后,溶液中[c(H+)·c(NH3·H2O)]/ c(NH4+)不变 |
| D.难溶电解质AB2饱和溶液中,c(A2+)=xmol·L-1,c(B-)="y" mo·L-1,则Ksp值为4xy2 |
25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
| A.向同浓度的Na2SO4和Na2CO3的混合溶液中滴加BaCl2溶液,BaSO4先析出 |
| B.向BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 |
C.BaSO4和BaCO3共存的悬浊液中, = = |
| D.向BaSO4的悬浊液中加入Na2CO3的浓溶液,BaSO4不可能转化为BaCO3 |
下表提供的玻璃仪器(非玻璃仪器任选)及现象描述均符合相应实脸目的的是
| 选项 |
实验目的 |
玻璃仪器 |
实验现象 |
| A |
硫化锌沉淀转化为硫化铜沉淀 |
试管、胶头滴管 |
白色沉淀转化为黑色沉淀 |
| B |
验证CO2的氧化性 |
酒精灯、集气瓶、玻璃片 |
镁条剧烈燃烧,产生白色的烟雾,瓶内壁有白色粉末 |
| C |
分离乙酸乙酯与乙酸 |
分液漏斗、烧杯 |
液体分层,上层为无色油状液体,上层液体和下层液体都从分液漏斗下口放出 |
| D |
实验室制取乙烯 |
酒精灯、圆底烧瓶、导管 |
加热后液体沸腾,液体逐渐变黑,并有气体产生 |
已知溶液中存在平衡:Ca(OH)2 (s)  Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的叙述正确的是( )
Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的叙述正确的是( )
| A.升高温度,固体的量减少 |
| B.加入少量Na2CO3粉末能增大钙离子的浓度 |
| C.降低温度,溶液中c(OH-)增大 |
| D.恒温下加入少量CaO,溶液的pH增大 |
用
滴定
溶液的滴定曲线如图所示。下列有关描述错误的是( )

| A. | 根据曲线数据计算可知 的数量级为 |
B. | 曲线上各点的溶液满足关系式 |
| C. | 相同实验条件下,若改为 , 反应终点c移到a |
D. | 相同实验条件下,若改为 , 反应终点c向b方向移动 |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(AgBr)=7.7×10-13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgBr >AgI>AgCl |
| C.AgBr >AgCl>AgI | D.AgCl> AgBr>AgI |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是( )
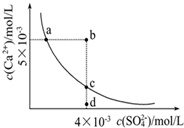
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
| A.2句 | B.3句 | C.4句 | D.5句 |
向盛有0.1mol/LAgNO3溶液的试管中滴加 0.05mol/LNa2S溶液至沉淀完全,再向上层清液中滴加足量 NaCl,产生的现象及发生的反应是
| A.黑色沉淀完全转化为白色沉淀 | B.既有Ag2S也有 AgCl |
| C.不能由黑色沉淀转变为白色沉淀 | D.只有 AgCl白色沉淀 |
下列叙述或表示正确的是( )
| A.0.1mol·L﹣1的醋酸的pH=a,0.01mol·L﹣1的醋酸的pH=b,则a+1=b |
| B.常温下0.1mol·L﹣1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO﹣)=0.1mol·L﹣1 |
| C.难溶电解质AB2的饱和溶液中,已知:c(A2+)="x" mol·L﹣1,c(B﹣)="y" mol·L﹣1,则Ksp值为4xy2 |
| D.用200mL4mol·L﹣1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为: 3CO2+4OH﹣=CO32﹣+2HCO3﹣+H2O |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11mol·L-1 ×10-11mol·L-1 |