用
滴定
溶液的滴定曲线如图所示。下列有关描述错误的是( )

| A. | 根据曲线数据计算可知 的数量级为 |
B. | 曲线上各点的溶液满足关系式 |
| C. | 相同实验条件下,若改为 , 反应终点c移到a |
D. | 相同实验条件下,若改为 , 反应终点c向b方向移动 |
已知常温下,KSP(AgCl)=1.8×10-10 mol2·L-2,KSP(AgI)=8.3×10-17mol2·L-2,下列叙述中, 正确的是( )
| A.常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 |
| B.向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 |
| C.将 0.001 mol·L-1的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 |
| D.向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(AgBr)=7.7×10-13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgBr >AgI>AgCl |
| C.AgBr >AgCl>AgI | D.AgCl> AgBr>AgI |
实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCI溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀C;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.c中颜色变化说明AgCI 转化为AgI |
| C.实验可以证明AgI比AgCI更难溶 |
| D.滤液b中不含有Ag+ |
下列化学实验事实及解释都正确的是
| A.向Na2S03溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2S03溶液已经变质 |
| B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
C.等体积、 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: |
D.向浓度均为0.1 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明 |
硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等。某温度时HgS在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
| A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小 |
| B.图中a点对应的是饱和溶液 |
| C.向c点的溶液中加入0.1mol/LHg(NO3)2,则c(S2-)减小 |
| D.升高温度可以实现c点到b点的转化 |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是( )
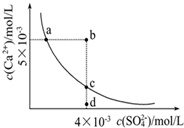
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
| A.2句 | B.3句 | C.4句 | D.5句 |
下列说法正确的是
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;②对于Al(OH)3(s)  Al(OH)3(aq)
Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡;③物质的溶解度随温度的升高而增加,物质的溶解都是吸热的;④除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
Al3++3OH-,前者为溶解平衡,后者为电离平衡;③物质的溶解度随温度的升高而增加,物质的溶解都是吸热的;④除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
| A.①②④⑤ | B.② | C.①③④⑤ | D.①②⑤ |
向AgCl沉淀中加入过量的KI溶液,白色沉淀转化为黄色沉淀。下列叙述错误的是( )
| A.加入过量的KI溶液充分反应后,Kw(AgCl)减小 |
| B.加入过量的KI溶液充分反应后,溶液中Ag+和I-的浓度之积等于Ksp(AgI) |
| C.加入过量的KI溶液充分反应后,溶液中Ag+和Cl-的浓度之积小于Ksp(AgCl) |
| D.Ksp(AgI)<Ksp(AgCl) |
下列说法正确的是 ( )
| A.某物质的溶解性为难溶,则该物质不溶于水 |
| B.不溶于水的物质的溶解度为0 |
| C.绝对不溶解的物质是不存在的 |
| D.某离子被沉淀完全是指该离子在溶液中的浓度为0 |
已知:Ksp(AgCl)=1.8×10-10;Ksp(Ag2S)=6.3×10-50。向盛0.1mol/L AgNO3溶液的试管中滴加0.1mol/L Na2S溶液至沉淀完全,再滴加足量NaCl溶液,产生的现象或生成的物质是
| A.黑色沉淀完全转化为白色沉淀 | B.既有氯化银也有硫化银 |
| C.只产生黑色硫化银沉淀 | D.只有氯化银白色沉淀 |
某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-、CO32-。取该溶液进行如下实验:
①取溶液少许,滴入AgNO3溶液产生白色沉淀;
②另取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解;
③另取原溶液500mL,加入过氧化钠固体,产生的沉淀的物质的量与加入过氧化钠的物质的量的关系如下图所示。

根据实验现象和数据分析,回答下列问题:
(1)de段发生的反应的离子方程式是 ;
(2)溶液中肯定存在的离子是 (用离子符号表示);
(3)溶液中可能存在的离子是 (用离子符号表示);
(4)原溶液中金属阳离子的浓度分别为 ;
(5)请在答题卡对应图上画出加入过氧化钠从0~1.1mol时,产生气体的物质的量随加入过氧化钠物质的量变化的曲线(假设生成的气体全部逸出)。
某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Al3+和K+。取该溶液200mL,加入过量浓NaOH溶液,加热,得到448mL气体(标准状况下测定),同时产生红褐色沉淀;过滤,洗涤,灼烧,得到3.2g固体;向上述滤液中加足量BaCl2溶液,得到9.32g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在5种离子 |
| B.SO42ˉ、NH4+一定存在,Clˉ可能不存在 |
| C.Clˉ一定存在,且c(Clˉ)≥0.3mol/L |
| D.CO32ˉ、Al3+一定不存在,K+可能存在 |
下列溶液均处于 25℃,有关叙述正确的是
| A.AgCl 在同浓度的CaCl2 和NaCl溶液中的溶解度相同 |
| B.0.1 mol∙L-1的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=4.5的番茄汁中 c(H+) 是 pH=6.5 的牛奶中 c(H+)的 100 倍 |