下列叙述或表示正确的是( )
| A.0.1mol·L﹣1的醋酸的pH=a,0.01mol·L﹣1的醋酸的pH=b,则a+1=b |
| B.常温下0.1mol·L﹣1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO﹣)=0.1mol·L﹣1 |
| C.难溶电解质AB2的饱和溶液中,已知:c(A2+)="x" mol·L﹣1,c(B﹣)="y" mol·L﹣1,则Ksp值为4xy2 |
| D.用200mL4mol·L﹣1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为: 3CO2+4OH﹣=CO32﹣+2HCO3﹣+H2O |
铁及其化合物与生活密切相关,古代炼丹家以绿矾(FeSO4·7H2O为原料,放在炼丹炉中锻烧可制得绿矾油。绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈。右图是2. 78 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g。


(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图

根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。
Cl2及其化合物在生产、生活中具有广泛的用途

(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图1所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是__________。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为____________。
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式____________。
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,NaClO3在_____极(填阴或阳)生成,生成ClO3–的电极反应式为__________________。
(4)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如图2所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号)。
②B → A + D反应的热化学方程式为 (用离子符号表示)。
在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24.下列有关说法中正确的是( )
| A.25℃时,CuS的溶解度大于ZnS的溶解度 |
| B.25℃时,向含有等物质的量的FeCl2和CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS |
| C.除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 |
D.将足量CuSO4溶解在0.1mol/L的H2S溶液中,S2-能达到的最大浓度为 |
25℃时,在含有大量的PbI2饱和溶液中存在平衡:PbI2(s) Pb2+(aq)+2I-(aq),向其中加入KI固体,下列说法正确的是 ( )
Pb2+(aq)+2I-(aq),向其中加入KI固体,下列说法正确的是 ( )
| A.溶液中Pb2+和I-浓度都增大 | B.溶度积常数Ksp增大 |
| C.沉淀溶解平衡向逆向移动 | D.PbI2的溶解度不变 |
(1)有浓度均为0.1 mol•L-1的 ①盐酸 ②硫酸 ③醋酸三种溶液,请用序号填空: 三种溶液的c(H+)大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为 ;若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH的大小关系为 。
(2)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的表达式: ,现将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)= mol/L(忽略溶液体积的变化)。
下列实验对应的现象及结论均正确且两者具有因果关系的是
| 选项 |
实验 |
现象 |
结论 |
| A |
SO2通入BaCl2溶液,然后滴入稀硝酸 |
白色沉淀,白色沉淀不溶于稀硝酸 |
所得沉淀为BaSO3,后转化为BaSO4 |
| B |
浓硫酸滴入蔗糖中,并搅拌 |
得黑色蓬松的固体并有刺激性气味气体 |
该过程中浓硫酸仅体现吸水性和脱水性 |
| C |
向FeCl2溶液中加入足量Na2O2粉末 |
出现红褐色沉淀和无色气体 |
FeCl2溶液部分变质 |
| D |
向足量含淀粉的FeI2溶液中滴加2滴氯水 |
溶液变蓝 |
还原性:I->Fe2+ |
已知PbI2的Ksp=7.0×10-9,将7.5×10-3 mol/L的KI与一定浓度的Pb(NO3)2溶液按2∶1体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为
| A.8.4×10-4 mol/L | B.5.6×10-4 mol/L |
| C.4.2×10-4 mol/L | D.2.8×10-4 mol/L |
已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25 ℃时,Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是
①20 mL 0.01 mol·L-1 KCl溶液 ②30 mL 0.02 mol·L-1 CaCl2溶液 ③40 mL 0.03 mol·L-1 HCl溶液
| A.①>②>③ | B.①>③>② | C.②>①>③ | D.③>②>① |
在BaSO4饱和溶液中加入少量的BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中
| A.c(Ba2+)=c(SO42-)=(Ksp)1/2 |
| B.c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-) |
| C.c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-) |
| D.c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
下列说法正确的是
| A.反应CaCO3(s)=CaO(s)+CO2(g),在常温下不能自发进行,则该反应的△H<0 |
B.0.lmol·L一1CH3COOH溶液加水稀释后,溶液中 的值减小 的值减小 |
| C.铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| D.锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
下列图示与对应的叙述相符的是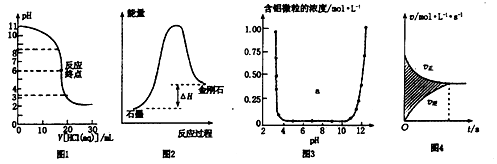
| A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线 |
| B.图2所示,石墨的熔点比金刚石低 |
| C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3 |
| D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕 |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11mol·L-1 ×10-11mol·L-1 |