目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2+3H2  CH3OH+H2O,该反应的能量变化如图所示:
CH3OH+H2O,该反应的能量变化如图所示:
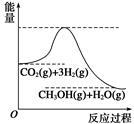
(1)甲同学认为该反应为放热反应,他的理由为: 。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)= ;反应达到平衡状态,此时H2的转化率为 。
| t/min |
0 |
2 |
5 |
10 |
15 |
| n(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.H2的消耗速率与CH3OH的消耗速率之比为3∶1
在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示。容器中发生以下反应:N2+3H2 2NH3(正反应为放热反应)。若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:
2NH3(正反应为放热反应)。若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:

(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各物质的体积仍与上述平衡时完全相同,那么:
①若a=1,c=2,则b=____。在此情况下,反应起始时将向______(填“正”或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c的范围是______。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是______,原因是 。
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X+Y 2Z+W △H<0(X、Y、Z、W均为气体),达到平衡时,V(A)=1.2aL,试回答:
2Z+W △H<0(X、Y、Z、W均为气体),达到平衡时,V(A)=1.2aL,试回答:
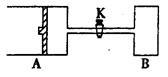
(1)A中X的转化率α(A)=________;
(2)A、B中X转化率的关系:α(A)_________ α(B)(填“>”、“=”“<”);
(3)打开K,一段时间又达到平衡时,A的体积为_______L(连通管中气体体积不计)
T ℃时,向2 L恒容密闭容器中充入1 mol NO2与2mol SO2发生如下反应:
NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1。
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1。
(1)下列能说明该反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗n mol SO3的同时生成n mol NO2
(2)反应进行到20 s 时,测得反应速率v(NO) =" 0.005" mol·L-1·s-1,则消耗的NO2为 mol。
(3)下列措施能使反应加快的是 (仅改变一个条件)
a.降低温度 b.缩小容积 c.使用效率更高的催化剂
(4)若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将 。
a.延长 b.缩短 c.不变 d.无法确定
300℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:
X(g) +Y(g) 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=
(2)能判断该反应已经达到平衡状态的是
A.生成X的速率是生成Z的速率的2倍
B.容器内压强保持不变
C.容器内气体的密度保持不变
D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是 (任写一种)。
(4)温度为300℃时,该反应的化学平衡常数K=
(5)若起始时向该容器中充入X、Y、Z各0.20 mol,则反应将向 (填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比 (填“增大”、“减小”或“不变”)
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
(1)关于该反应的下列说法中,正确的是_________(填字母)。
A.ΔH<0,ΔS<0 B.ΔH>0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH<0,ΔS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,H2的平均反应速率v(H2)= ;CO2的转化率w(CO2)= 。
②该反应的平衡常数K= 。(只列表达式和计算式,不必计算出结果)
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.将CH3OH(g)及时液化抽出 B.升高温度
C.选择高效催化剂 D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16 g 液态甲醇完全燃烧,当恢复到原状态时,放出350.8kJ的热量,写出该反应的热化学方程式: 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,其负极的电极反应式是: 。
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,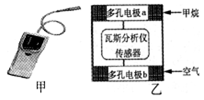
其中的固体电解质是Y2O3—Na2O,O2-可以在其中自由移动。下列有关叙述不正确的是
| A.电极b是正极,内电路中O2-由电极b流向电极a |
| B.电极a的反应式为:CH4 +4O2--8e-=CO2 +2H2O |
| C.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| D.当固体电解质中有1 mol O2- 通过时,电子转移2 mol |
I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为 ;
(3)计算该反应的平衡常数K= 。
(4)①反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)="0.9" mol/L。第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是_____L。
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
(1)该反应的化学方程式为: 。
(2)反应开始至2min,用Z表示的平均反应速率为: 。
(3)下列叙述能说明上述反应达到化学平衡状态的是 (填序号)
| A.混合气体的总物质的量不随时间的变化而变化 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗3mol X,同时生成2 mol Z |
| D.混合气体的总质量不随时间的变化而变化 |
E.恒定容积,混合气体的密度不再发生改变
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+ Y(g) 2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
①升高温度,反应速率 ;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率 。
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g) + CO(g)  CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是 (填序号)。
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的平均相对分子质量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2加压
e.加入惰性气体加压
f.分离出甲醇
③300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/ c(CH3OH)减小
④某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 。以CH3OH表示该过程的反应速率v(CH3OH)= mol /(L · min)。
(3)下图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A____C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_____C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。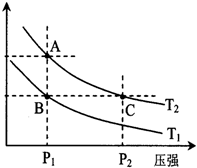
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1
③H2O(g)= H2O(l) ΔH=-c kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(l) ΔH= kJ·mol-1。
Ⅰ.在一定条件下,xA+yB  zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向___ ___移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为___ ___。
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
(1)图中共有两条曲线X和Y,其中曲线_______表示NO2浓度随时间的变化;a、b、c、d四个点中,
表示化学反应处于平衡状态的点是__________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=_______mol·L-1·min-1。
②0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数Kb=_______。
N2O4(g)的平衡常数Kb=_______。
③25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数Kd_____Kb(填“>”、“=”或“<”)。
N2O4(g)的平衡常数Kd_____Kb(填“>”、“=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________。
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N2O4
近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示。(已知: )
)
①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热) 反应。
N2(g)+O2(g)为(填“吸热”或“放热) 反应。
②一定温度下,能够说明反应 2NO(g) N2(g)+O2(g)已达到平衡的是(填序号) 。
N2(g)+O2(g)已达到平衡的是(填序号) 。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用 CxHy(烃)催化还原NO2消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)=CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1,
△H2= .
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 。
合成氨工业的核心反应是:N2(g)+3H2(g)  2NH3(g) ΔH="Q" kJ·mol-1,能量变化如图所示,回答下列问题:
2NH3(g) ΔH="Q" kJ·mol-1,能量变化如图所示,回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________(填“增大”、“减小”、“不变”)
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_________ 46.2 kJ(填“<”、“>”或“=”)
(3)关于该反应的下列说法中,正确的是_________。
A.ΔH>0,气体分子数目增多 B.ΔH>0,气体分子数目减少
C.ΔH<0,气体分子数目增多 D.ΔH<0,气体分子数目减少
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率_________。若升高温度,K值变化_______(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中欲提高合成氨中H2的转化率,下列措施可行的__(填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨气
(14分)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤。
(1)一定条件下,SO2可发生反应:SO2(g)+ O2(g)
O2(g) SO3(g) △H=﹣98kJ·mol﹣1。
SO3(g) △H=﹣98kJ·mol﹣1。
①某温度下,在100 L的恒容密闭容器中开始加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=_______(用分数表示)。
②上述反应按照相同的物质的量投料,测得SO2在不同温度下的平衡转化率a%与压强的关系如下图所示。下列说法正确的是_______(填序号)。
| A.温度:T3>T2>T1 |
| B.正反应速率:v(c)>v(a),v(b)>v(d) |
| C.平衡常数:K(a)>k(c),K(b)=K(d) |
| D.平均摩尔质量:M(a)>M(c),M(b)>M(d) |
③上述反应达平衡后,保持温度和容器的压强不变,若再通入一定量SO3(g),则SO2的体积分数_______(填“增大”、“减小”、“不变”)。
(2)某人设想以下图所示装置用电化学原理模拟生产硫酸: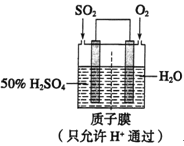
①通入O2的电极是________极。
②写出通入SO2的电极的电极反应式:_______________
③若此过程中转移了0.2mol电子,则质子膜两侧电解液的质量变化差(△m左﹣△m右)为________g(忽略气体的溶解)。
(12分)
(1)在一体积为10L的容器中,通入一定量的CO和H2O。在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0 CO和H2O浓度变化如图,
CO2(g)+H2(g) △H<0 CO和H2O浓度变化如图,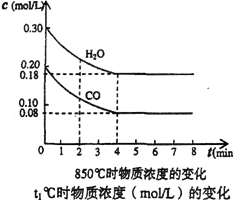
则0~4min的平均反应速率v(CO)= ______,达到平衡时,H2O(g)的转化率为_________。
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
①表中3min~4min之间反应处于________状态; C1数值________0.08mol/L(填>,<,=)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________(单选),表中5min~6min之间数值发生变化,可能的原因是_________(单选)。
| A.加水蒸气 | B.降低温度 | C.使用催化剂 | D.增加氢气浓度 |