湖南省娄底市高二下学期期末考试化学试卷
对于资源的合理开发利用,下列过程中只发生物理变化的是
| A.煤的干馏 | B.从海带中提取碘 | C.石油的分馏 | D.石油裂化 |
下列物质中属于有机物的是
①酒精;②食盐;③一氧化碳;④甲烷;⑤红糖;⑥石灰石
| A.①②④⑤ | B.①④⑤ | C.①③⑤ | D.①⑤⑥ |
自然界为人类提供了多种多样的营养物质,下列有关营养物质的说法正确的是
| A.所有的油脂都不能使溴水褪色 |
| B.棉花和蚕丝的主要成份都是纤维素 |
| C.蔗糖、淀粉、油脂等都可以发生水解反应 |
| D.食用纤维素、淀粉、蛋白质、植物油都是高分子化合物 |
据报道,美国科学家制得一种新原子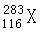 ,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是
,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是
| A.这种元素一定是金属元素 | B.它位于元素周期表中的第六周期 |
| C.这种原子的中子数为167 | D.这种元素的原子易失去电子 |
下列物质中,属于含有极性共价键的离子化合物的是
| A.MgCl2 | B.Br2 | C.KOH | D.CH3COOH |
下列有关化学用语表达不正确的是
| A.CO2分子的结构式: O=C=O |
| B.氯气分子的电子式 Cl:Cl |
C.Cl-的离子结构示意图: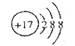 |
D.原子核内有10个中子的氧原子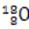 |
X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
| A.XH4 | B.XH3 | C.H2X | D.HX |
W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是
| A.阴离子的还原性:W>Z | B.单质的沸点:W>X |
| C.氧化物的水化物的酸性:Y<Z | D.X与Y不能存在于同一离子化合物中 |
XY2是由短周期元素形成的化合物,Y-比X2+多一个电子层,Y-与氩原子的电子层结构相同。下列有关叙述不正确的是
| A.Y是第ⅦA族元素 | B.化合物XY2的化学键为离子键 |
| C.Y-与X2+的最外层电子数相同 | D.X是第二周期元素 |
保护环境已成为人类的共识。下列物质与所对应的环境问题没有关系的是
| A |
B |
C |
D |
| 建筑垃圾 |
二氧化碳 |
氟利昂 |
二氧化硫 |
| 白色污染 |
温室效应 |
臭氧层受损 |
酸雨 |
化学反应中往往伴随着能量的变化。下列反应,既属于氧化还原反应,又属于放热反应的是
| A.石灰石的分解反应 | B.铝热反应 |
| C.Ba(OH)2·8H2O 与NH4Cl反应 | D.NaOH与稀盐酸反应 |
2mol/L的盐酸100mL和过量的锌片反应,为了加大反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量蒸馏水 | B.加入适量的氯化钠 |
| C.加入适量的6mol/L盐酸 | D.加入数滴氯化铜溶液 |
若以稀硫酸作电解质溶液,则关于铜锌原电池的叙述,正确的是
| A.铜是正极,铜片上有气泡产生 | B.氢离子在锌片表面被还原 |
| C.电流从锌片经导线流向铜片 | D.铜片质量逐渐减少 |
在2L密闭容器中,发生3A+B =" 2C" (均为气体)的反应,若最初加入A和B都是4mol, A的平均反应速率是0.12mol/(L.s),则10s后容器中的B的物质的量是
| A.1.6mol | B.3.2mol | C.3.6mol | D.2.8mol |
下列反应属于取代反应的是
| A.乙烯 → 乙醇 | B.乙酸 →乙酸乙酯 |
| C.苯 → 环己烷 | D.乙醇 → 乙醛 |
下列化学方程式书写错误的是
A.乙醇催化氧化制取乙醛:2CH3CH2OH+O2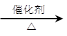 2CH3CHO+2H2O 2CH3CHO+2H2O |
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯: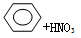  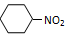 + H2O + H2O |
C.乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH + CH3COOH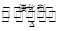 CH3COOC2H5 + H2O CH3COOC2H5 + H2O |
| D.乙烯使溴的四氯化碳溶液褪色:CH2=CH2+ Br2 → CH2Br-CH2Br |
下列有关说法正确的是
| A.H与D互为同位素;葡萄糖和蔗糖互为同系物 |
| B.乙烷气体中混有乙烯,通入酸性高锰酸钾溶液,从而除去乙烯 |
| C.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 |
| D.证明CH3CH2CH=CHCH2CH2OH分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色 |
某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
| A.C14H18O5 | B.C16H22O5 | C.C14H16O4 | D.C16H20O5 |
“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用。下列化学反应,不符合绿色化学的是
| A.消除硫酸厂尾气排放:SO2+2NH3+H2O===(NH4)2SO3 |
| B.消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH===2NaNO2+H2O |
| C.制CuSO4:Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O |
D.制CuSO4:2Cu+O2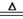 2CuO ,CuO+H2SO4(稀)===CuSO4+H2O 2CuO ,CuO+H2SO4(稀)===CuSO4+H2O |
(1)为了达到下表中的实验要求,请从“供选择的化学试剂及方法”栏中,选择正确选项的字母代号填入对应的空格中。
| 序号 |
实验要求 |
答案 |
供选择的化学试剂及方法 |
| a |
检验乙酸是否具有酸性 |
|
A.新制的氢氧化铜悬浊液 |
| b |
检验植物油中是否含有碳碳双键 |
|
B.紫色石蕊试液 |
| c |
检验尿液中是否含有葡萄糖 |
|
C.加入饱和Na2CO3溶液,分液 |
| d |
除去乙酸乙酯中的少量乙酸 |
|
D.溴水 |
(2)A的结构简式如下:A分子中两种含氧官能团的名称是 、 。
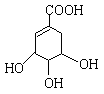
请写出该物质与足量的金属钠发生反应的化学方程式 。
(1)已知甲烷燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-=CO32-+7H2O这个电极是燃料电池的 (填“正极” 或“负极”),另一个电极上的电极反应式为:
(2)已知吸热反应2HI(g) ===H2(g) + I2(g)吸收热量11kJ,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。
目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2+3H2  CH3OH+H2O,该反应的能量变化如图所示:
CH3OH+H2O,该反应的能量变化如图所示:
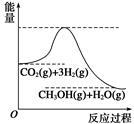
(1)甲同学认为该反应为放热反应,他的理由为: 。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)= ;反应达到平衡状态,此时H2的转化率为 。
| t/min |
0 |
2 |
5 |
10 |
15 |
| n(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.H2的消耗速率与CH3OH的消耗速率之比为3∶1
为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求填写下列空格:
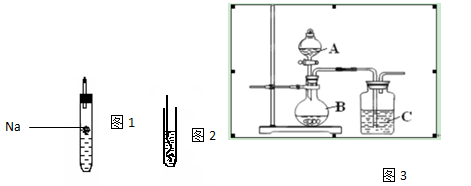
(I)如上图1所示,试管中装乙醇,(图示不一定准确)则反应现象为 ;
(II)如上图2所示,把加热的铜丝插入到装有乙醇的试管中,闻到有刺激性气味,该反应中产生的有机物为 ;(填结构简式);
(III)为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图3所示装置来进行实验验证。
①A中所盛试剂为___ ____。
②C中实验现象为 ,由实验可知这三种酸的酸性大小为 。
③该装置中存在不妥之处,请提出改正措施 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号