甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g) + CO(g)  CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是 (填序号)。
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的平均相对分子质量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2加压
e.加入惰性气体加压
f.分离出甲醇
③300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/ c(CH3OH)减小
④某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 。以CH3OH表示该过程的反应速率v(CH3OH)= mol /(L · min)。
(3)下图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A____C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_____C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1
③H2O(g)= H2O(l) ΔH=-c kJ·mol-1
则,CH3OH(l)+O2(g) =CO(g)+2H2O(l) ΔH= kJ·mol-1。
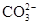
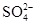 HCO3-
HCO3-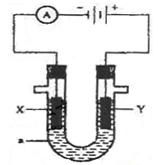
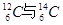 、② O2与O3、③ 正丁烷与异丁烷、④ 金刚石与石墨、⑤ 冰与水、⑥ 乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是( );(2)互为同素异形体的是 ( );(3)互为同分异构体的是( );(4)属于同一化合物的是 ( )
、② O2与O3、③ 正丁烷与异丁烷、④ 金刚石与石墨、⑤ 冰与水、⑥ 乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是( );(2)互为同素异形体的是 ( );(3)互为同分异构体的是( );(4)属于同一化合物的是 ( ) 粤公网安备 44130202000953号
粤公网安备 44130202000953号