氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 |
大气固氮 N2 (g)+O2 (g)  2NO(g) 2NO(g) |
工业固氮 N2 (g)+3H2 (g)  2NH3(g) 2NH3(g) |
|||
| 温度/℃ |
27 |
2000 |
25[ |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
0.507 |
0.152 |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是______(填“A”或“B”);比较р1、р2的大小关系_______。
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1) 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
(已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g) 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
在2 L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡。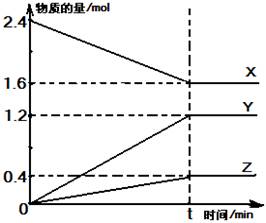
(1)该反应的化学方程式是 。
(2)反应起始至t时刻,Y的平均反应速率是 。
(3)关于该反应的说法,正确的是 。
| A.到达t时刻该反应已停止 |
| B.加入催化剂,一定能加快反应速率 |
| C.在t时刻正反应速率等于逆反应速率 |
| D.增大压强,一定能加快反应速率 |
(16分)能源、环境与生产生活和社会发展密切相关。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2(g)和3molH2(g) |
1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出29.4kJ |
吸收akJ |
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
①cl__________c2(填“>”、“<”或“=”),a=____________;
②该温度下反应的平衡常数K=__________;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=__________。
③下列情况能说明该反应一定达到平衡状态的是________(填字母编号);
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
④其他条件不变,达到平衡后,下列不能提高H2转化率的操作是________(填字母编号)。
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
(2)工业生产中H2S尾气可用NaOH溶液吸收。常温下,用a mol·L-1的NaOH溶液吸收尾气后得到的溶液中c(S2-)=c(OH-),此时溶液的pH=12,则此时溶液中的溶质为_________(填化学式),溶液中c(HS-)=__________mol·L-1(用含a的代数式表示,溶液体积变化忽略不计)。
硝基苯甲酸乙酯在OH — 存在下发生水解反应:O2NC6H4COOC2H5+OH-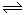 O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示,回答下列问题:
(1)列式计算该反应在120~180s与330~530s区间的平均反应速率__________,__________;比较两者大小可得出的结论是______________________________。
(2)列式计算该温度下反应的平衡常数____________________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,可以采取的措施有_______________(要求写出两条)。
(4)硝基苯甲酸乙酯有 种,其中苯环上的一氯代物最少的结构简式为 。
(选考)某磷肥厂利用某磷矿石[Ca3(PO4)2]制取磷肥并综合利用副产物生产水泥的工艺流程如下:
(1)将磷矿石制成磷肥的目的是 ,有关的化学方程式为 。
(2)在该工艺流程中高硫煤粉不需要脱硫,理由是 。
(3)水泥属于 材料。
(填“A”或者“B”:A.新型无机非金属材料 B.传统无机非金属材料)
(4)工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应.现将2mol SO2、1mol O2充入体积为2L的密闭容器中充分反应,放出热量98.3kJ,此时测得SO2的物质的量为1mol.则该热化学方程式为 ,平衡常数K为 。
(5)工业上用接触法制硫酸,最后的产品是98%的硫酸或组成为2H2SO4·SO3的发烟硫酸(H2SO4和H2SO4·SO3的混合物,其中SO3的质量分数约为29%)。若98%的浓硫酸可表示为SO3·aH2O,含SO329%的发烟硫酸可表示为bSO3·H2O,则a= ,b= 。
(1)某温度下,2 L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则

①反应的化学方程式为___________________________________________________;
②0~10 s内,用Z表示的化学反应速率____________________________________;
③X的转化率为__________________;(转化率是指平衡时某物质反应的物质的量与起始物质的量的百分比)
(2)在一定温度下,可逆反应A(g)+3B(g)  2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.A的生成速率与C分解的速率相等
B.单位时间内生成nmolA,同时生3nmolB
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1:3:2
一定温度下,向容积为2L的密闭容器中通入3 molA和2mol B,混合气体起始压强为p0。发生如下反应:3A(g)+B(g) xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
(1)X为 。
(2)反应在1min内,B的平均反应速率为 ;
(3)请用p0、p来表示2min时反应物B的转化率为 %。
(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是 ;
A.v(A)="0.5" mol·L-1·min-1
B.v(B)="0.2" mol·L-1·min-1
C.v(C)="0.3" mol·L-1·min-1
D.v(D)="0.5" mol·L-1·min-1
I.已知0.3 mol的气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,其热化学方程式为: 。
II.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L)。反应在前10min内的平均速率为ν(t-BuNO)= 计算上述反应的平衡常数K = 。
(2)有关反应:(t-BuNO)2 2(t-BuNO) 的叙述正确的是( )
2(t-BuNO) 的叙述正确的是( )
A.压强越大,反应物的转化率越大
B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
III.甲醇燃料电池的电解质溶液是KOH溶液。则负极的电极反应式为 。
(15分)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成CO,充分燃烧时生成CO2,反应放出的能量如图1所示
(1)在通常状况下, 更稳定(填“金刚石”或“石墨”),金刚石转化为石墨的热化学方程式为 。
(2)CO、O2和熔融Na2CO3可制作燃料电池,其原理见图2。石墨Ⅰ上电极反应式为 。
(3)用CO2生产甲醇燃料的方法为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6 mol。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6 mol。
①下列时间段平均反应速率最大的是 。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
②仅改变某一个实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 ,体积不变,再充入3molCO2和4molH2,H2O(g)的体积分数 (填“增大”“减小”或“不变”)。
Ⅰ.化学反应总是伴随能量变化,已知下列化学反应的焓变
2HI(g)=H2(g)+I2(g) △H1
SO2(g)+ I2(g) + 2H2O(g)=H2SO4(l)+2HI(g) △H2
H2SO4(l)=H2O(g) + SO2(g) +1/2O2(g) △H3
2H2O(g)=2H2(g)+ O2 (g) △H4
(1)△H4与△H1、△H2、△H3之间的关系是:△H4= 。
(2)若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) 在150℃下能自发进行,则△H ____ 0
A.大于 B.小于 C.等于 D.大于或小于都可
Ⅱ.以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) △H=QkJ/mol (Q>0)
CH3CH2OH(g)+3H2O(g) △H=QkJ/mol (Q>0)
在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。完成下列填空: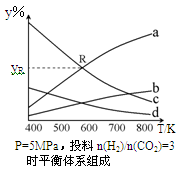
(1)表示CH3CH2OH体积分数曲线的是____(选填序号)
(2)在一定温度下反应达到平衡的标志是_____
A.平衡常数K不再增大
B.CO2的转化率不再增大
C.混合气体的平均相对分子质量不再改变
D.反应物不再转化为生成物
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是_______(选填编号);达到平衡后,能提高H2转化率的操作是_______(选填编号)
A.降低温度 B.充入更多的H2 C.移去乙醇 D.增大容器体积
(4)图中曲线a和c的交点R对应物质的体积分数yR=_______%
PM2.5污染跟工业燃煤密切相关,燃煤还同时排放大量的SO2和NOX。
(1)在一定条件下,SO2气体可被氧气氧化,每生成8 g SO3气体,放出9.83 kJ的热量,写出该反应的热化学方程式 。若起始时向密闭容器内充入0.4molSO2和0.2mol O2,达平衡后放出的热量为Q,则Q 39.32kJ(填“>”、“<”或“=”).
(2)一定条件下,在恒容密闭的容器中,当上述反应达到平衡时,下列说法正确的是__________(填序号)
a.2v逆(SO2)=v正(O2)
b.ΔH保持不变
c.混合气体密度保持不变
d.混合气体的平均相对分子质量保持不变
(3)500℃时,在催化剂存在条件下,分别将2 mol SO2和1 mol O2置于恒压容器I和恒容容器II中(两容器起始容积相同,),充分反应均达到平衡后,两容器中SO2的转化率关系是I_________II(填“>”、“<”或“=”)。若测得容器II中的压强减小了30%,则该容器中SO3体积分数为 (结果保留3位有效数字)。
(4)将生成的SO3溶于水,再向溶液中通入NH3得到1L cmol/L(NH4)2SO4溶液的PH=5,计算该(NH4)2SO4溶液的水解平衡常数Kh= 。
(5)NO2、O2和熔融NaNO3可制作原电池,其装置见下图。该电池中Na+向 _____电极移动(填“Ⅰ”或“Ⅱ”),在电池使用过程中石墨I电极上生成氧化物Y,其电极反应为 。
恒温恒容下,将2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(2)x=________。
(3)A的转化率与B的转化率之比为________。
汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为(用化学方程式表示为可逆反应)________;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因________。
(2)治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的和,反应原理为: 2CO(g)+2NO (g) 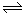 CO2(g)+N2 (g) △H<0,某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4 mol NO和0.4 molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:
CO2(g)+N2 (g) △H<0,某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.4 mol NO和0.4 molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示: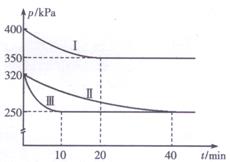
①计算实验Ⅱ从开始至达到平衡时的反应速率v(N0)=________。
②图中三组实验从开始至达到平衡时的反应速率v( NO)由大到小的顺序为__________(填实验序号)。
③与实验Ⅱ相比,实验I和实验Ⅲ分别仅改变一种反应条件,所改变的条件和判断的理由为:
实验I__________________________________________;
实验Ⅲ________________________________________。
④三组实验中CO的平衡转化率α1(CO)、αII(CO)和αIII(CO)的大小关系为____________。
⑤计算实验Ⅲ的平衡常数K=____________。
I.短周期元素X、Y、Z在元素周期表中的位置如下图所示,其中Y元素原子的最外层电子数是电子层数的两倍。回答下列问题:
(1)Y元素在元素周期表中的位置是 。
(2)列举一个事实证明Y元素与Z元素的非金属性强弱: 。
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐。该盐溶液的pH 7(填“<”、“>”或“=”),其原因为(用离子方程式表示) 。
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键。该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体。该反应的化学方程式为 。
II.已知可逆反应:CO(g)+H2O(g)  CO2(g)+H2(g),平衡常数见下表:
CO2(g)+H2(g),平衡常数见下表:
| 温度/℃ |
500 |
700 |
850 |
1 000 |
| 平衡常数 |
2.5 |
1.7 |
1.0 |
0.6 |
(5)该反应ΔH 0(填“<”或“>”)。
(6)850 ℃时,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 molCO2和x mol H2,若要使上述反应开始时正向进行,则x应满足的条件是 。
若x=5.0,当反应达到平衡时,n(H2)= 。
X是短周期中原子半径最小的元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;
(1)Y的原子结构示意图是_______________.
(2)甲的水溶液与硫酸铝溶液反应离子方程式 .
(3)甲与氯化氢反应生成乙.乙所含化学键类型有 .在0.1mol•L﹣1乙溶液中,所含离子浓度由大到小的顺序是 .
(4)工业上,可通过如下转化制得尿素晶体:
①Ⅰ中恒温恒容条件下,能同时提高化学反应速率和NH3产率的是 。
②反应Ⅱ:2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
(i)此反应的平衡常数表达式K= 。升高温度,K值 (填增大、减小或不变)。
(ii)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。
已知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 =" -1806.4" kJ·mol-1
写出CO(NH2)2(g)与NO反应的热化学方程式 。