湖南省怀化市高三下学期第三次质量监测理综化学试卷
下列说法正确的是
| A.蛋白质在空气中完全燃烧转化为水和二氧化碳 |
| B.汽油、甘油、花生油都属于酯类物质 |
| C.麦芽糖及其水解产物均能发生银镜反应 |
| D.燃煤产生的二氧化硫是引起雾霾的主要原因 |
下图是部分短周期主族元素原子半径与原子序数的关系图。则下列说法正确的是
| A.Y、O两种元素的离子半径相比,前者较大 |
| B.Z的氧化物能分别溶解于Y的最高氧化物的水化物和O的氢化物的水溶液 |
| C.由X与Y两种元素组成的化合物只含离子键 |
| D.X、N两种元素的气态氢化物的稳定性相比,后者较强 |
下列反应的离子方程式正确的是
| A.过氧化钠固体与水反应制氧气:2O22—+2H2O=4OH-+O2↑ |
| B.在100ml浓度为1 mol · L-1的Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O==2Fe2++SO42-+4H+ |
| C.1mo·L-1的NaAlO2溶液和2.5mol· L-1的盐酸等体积混合:2AlO2-+ 5 H+=Al(OH)3 ↓+ Al3++ H2 O |
| D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO+H+=== HCO |
某饱和一元酯C5H10O2,在酸性条件下水解生成甲和乙两种有机物,乙在铜的催化作用下能氧化为醛,满足以上条件的酯有
| A.6种 | B.7种 | C.8种 | D.9种 |
下列图示与对应的叙述相符的是
| A.由图1所示曲线可知,化学催化比酶催化的效果好 |
| B.在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2 |
C.在其它条件不变时,2SO2(g)+ O2(g) 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 |
| D.图4是用0.l000 mol/L的盐酸滴定20.00 mL 0.l000mol/LNa2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.1 mol FeI2与足量氯气反应时转移的电子数为2NA |
| B.1 L 1mol/L的盐酸含有NA个HCl分子 |
| C.标准状况下,33.6 L四氯化碳中含有氯原子的数目为6NA |
D.5NH4NO3 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
如图是CO2电催化还原为CH4的工作原理示意图。正确的是
| A.该装置为原电池,其中a为正极 |
| B.铜电极的电极反应式为:CO2+8H++8e-=CH4+2H2O |
| C.反应开始后,电子从a极流出至铜电极,经电解质溶液到铂电极最后流回至b极 |
| D.一段时间后,②池中溶液的pH不变 |
(15分)某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收。其工业流程如下:
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是 。
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是 ,溶液a中发生的反应的离子方程式为 。
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为 g(用含x、y的代数式表示)。
(4)将溶液c调节pH至2.9-3.2的目的是 。
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至 。
(6)工业上由红棕色固体C制取相应单质常用的方法是 。
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为 。
Ⅰ.在含有弱电解质的溶液中,往往有多个化学平衡共存。一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入少量CH3COONa固体。
(1)CH3COOH溶液的电离平衡 移动(填“向左”、“向右”或“不”),溶液中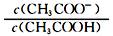 (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若该溶液呈酸性,则溶液中各离子浓度由大到小的顺序为: 。
Ⅱ、开发新能源和三废处理都是可持续发展的重要方面。
(1)H2、CO、CH3OH都是重要能源物质,它们燃烧热依次为285.8KJ/mol、281.5KJ/mol、726.7KJ/mol.已知CO、H2在一定条件下可以合成甲醇CO(g)+2H2(g)=CH3OH(l)。则该合成甲醇的热化学方程式为
(2)CO在催化剂作用下可以与H2反应生成甲醇:
CO(g)+2H2(g) CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。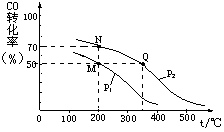
则M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 ;P1 P2(填“>”或“<”或“=”);
M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总= 。
二氯化二硫(S2Cl2),常温下是一种黄红色液体,有窒息性,刺激性恶臭,熔点80℃,沸点135.6℃,在空气中强烈产生烟雾,遇水、醇即分解;它常用于橡胶的低温硫化和黏接剂,国防工业用作军用毒气。它的工业合成方法:将氯气通入到熔融的硫单质发生反应而制得。实验室用下列装置制取少量S2Cl2。
请回答下列问题:
(1)S2Cl2分子中各原子均达到8电子稳定结构,则它的结构式为 。
(2)下列方法都可以制得氯气,其中符合装置A制取的有 。
a、MnO2固体和浓HCl共热
b、KMnO4固体和浓HCl反应
c、KClO3固体和浓HCl反应
d、MnO2固体、NaCl固体和浓硫酸共热
(3)装置A中用恒压分液漏斗而不用普通分液漏斗的原因是 。
(4)B中饱和食盐水的作用 ,装置C中的试剂是 。
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式 ,其氧化剂与还原剂物质的量之比为 。
(6)从安全和环保方面考虑,补全F方框内剩下的装置并注明装置中的药品。画图时,仪器可以简化,如下列仪器可以分别表示为:
(选考)某磷肥厂利用某磷矿石[Ca3(PO4)2]制取磷肥并综合利用副产物生产水泥的工艺流程如下:
(1)将磷矿石制成磷肥的目的是 ,有关的化学方程式为 。
(2)在该工艺流程中高硫煤粉不需要脱硫,理由是 。
(3)水泥属于 材料。
(填“A”或者“B”:A.新型无机非金属材料 B.传统无机非金属材料)
(4)工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应.现将2mol SO2、1mol O2充入体积为2L的密闭容器中充分反应,放出热量98.3kJ,此时测得SO2的物质的量为1mol.则该热化学方程式为 ,平衡常数K为 。
(5)工业上用接触法制硫酸,最后的产品是98%的硫酸或组成为2H2SO4·SO3的发烟硫酸(H2SO4和H2SO4·SO3的混合物,其中SO3的质量分数约为29%)。若98%的浓硫酸可表示为SO3·aH2O,含SO329%的发烟硫酸可表示为bSO3·H2O,则a= ,b= 。
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第四周期第ⅠB 族。Cu2+的核外电子排布式为 。
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图2:下列说法正确的是 (填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是: 。
(5)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因: 。
(6)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是________
(7)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________________;
Ⅰ.化合物E可以通过下图所示的路线合成:
(1)A中含有的官能团名称为 。除不稳定的乙烯醇(CH2=CHOH)外,A的另一种同分异构体的结构简式是____________。
(2)写出D与过量NaOH溶液完全反应的化学方程式。(有机物用结构简式表示)_________________
(3)若化合物E中带“*”号的C原子来自D中的①甲基,且该反应的副产物是甲醇,则D→E的反应类型是 。
Ⅱ.我国盛产山茶籽精油,其主要成分柠檬醛可以合成具有工业价值的β紫罗兰酮。
(4)①要检验柠檬醛中含有碳碳双键,需要使用下列试剂中的 (按反应顺序填试剂序号)。
A.氢氧化钠溶液 B.酸性高锰酸钾溶液
C.银氨溶液 D.碳酸钠溶液
②写出柠檬醛和新制氢氧化铜反应的化学方程式: 。
③柠檬醛有多种同分异构体,能满足下列条件的同分异构体有 种。
A.含有一个 的六元环结构,六元环上只有一个取代基
的六元环结构,六元环上只有一个取代基
B.能发生银镜反应
 粤公网安备 44130202000953号
粤公网安备 44130202000953号