氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)500°C、50Mpa时,在容积为VL的密闭容器中加入n mol N2、3n mol H2,经过t min后反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为 ;t min内用NH3表示的速率是 mol/L.min
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g)+92.2kJ/mol
2NH3(g)+92.2kJ/mol
(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol
在固定容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:

(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 。反应的平衡常数K1= 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②100℃时达到平衡后,向容器中再充入0.20mol NO2气体,新平衡建立后,NO2的体积分数
(填“增大”、“不变”或“减小”)
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
在1.0L密闭容器中放入l.0molX(g),在一定温度进行如下反应:
X(g) Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:

回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H__________0(填>、<或=)
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是__________。
| A.缩小容器容积 | B.及时分离出Y、Z | C.使用合理的催化剂 | D.升高体系温度 |
(3)计算平衡时X的转化率为__________,该温度下反应的平衡常数值为:___________。
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=__ mol,n(X)=__ mol,反应物X的转化率a(X)的表达式为__________。
(10分)有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比为2∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO2+O2 2SO3,并达到平衡。
2SO3,并达到平衡。
(1) 达到平衡所需时间,A容器比B容器___________,两容器中SO2的转化率A比B______________。
(2) 达到(1)所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡____________移动。
(3) 达到(1)所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数________________,B容器中SO3的体积分数__________________(填变大、变小、不变)。
进入秋冬季节后,郑州市频现雾霾天气,给人们的出行带来极大的不便和危害,人们“谈霾色变”。目前郑州市汽车保有量达230万量,汽车尾气的污染是引起雾霾的主要因素之一,NO和CO是汽车尾气的主要污染物。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)  SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
(2)某科研机构设计传感器检测CO的含量,其工作原理示意图如下:

Pt电极上发生的是 反应(填“氧化”或“还原”);写出NiO电极的电极反应式
(3)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,用化学方程式表示其原理
(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
| |
700℃ |
900℃ |
| K1 |
1.47 |
2.15 |
| K2 |
2.38 |
1.67 |
①反应CO2(g)+ H2(g) CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g)
CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g) CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g)+ H2(g) CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O
D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
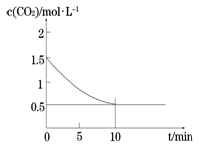
①该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时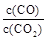 增大的是____________(填序号)。
增大的是____________(填序号)。
A.升高温度
B.增大压强
C.充入一定量的CO2
D.再加入一定量铁粉
将一定量的A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s) 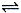 2C(g)。忽略固体的体积,平衡时A的体积分数(%)随温度和压强的变化如下表所示:
2C(g)。忽略固体的体积,平衡时A的体积分数(%)随温度和压强的变化如下表所示:
 压强/MPa 压强/MPa 体积分数/% 体积分数/%温度/℃ |
1.0 |
2.0 |
3.0 |
| 810 |
46.0 |
a |
b |
| 915 |
c |
25.0 |
d |
| 1000 |
e |
f |
15.0 |
回答下列问题:
(1)欲提高C的产率,应采取的措施为 ;
(2)该反应△H 0(填“<”或“>”);
(3)比较K(810℃) K(915℃) (填“<”、“>”或“=”),说明理由 ;
(4)915℃ 2.0MP时A的转化率为 ;
(5)比较b f(填“<”、“>”或“=”),说明理由 ;
(6)若1000℃,3.0MPa时,向容器中加入0.16mol A和0.20mol B,平衡时容器体积为10L,则此时平衡常数K= (保留两位有效数字)。
自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题。
(1).已知N2(g)+O2(g)=2NO(g) ΔH=+180.5KJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH= -566.0 KJ·mol-1
则加催化剂处理汽车尾气的热化学方程是
(2).反应2NO2(g)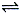 2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
| 时间(s) |
0 |
10 |
20 |
25 |
30 |
| 条件A [n(NO2)](mol) |
0.20 |
0.14 |
0.13 |
0.13 |
0.13 |
| 条件B [n(NO2)](mol) |
0.20 |
0.10 |
0.10 |
0.10 |
0.10 |
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO) B.c(NO2)=c(NO) C.O2的物质的量不变
D.混合气体的密度不变 E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为 mol·L-1·s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应 (填“正向”、“逆向”或“不移动”)。
甲醇是一种重要的可再生能源,可以通过下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率υ(H2)=________________________。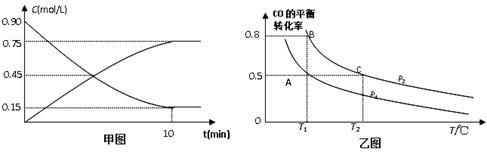
(2)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_________________。
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中混合气体的密度不再改变
D.体系中气体的平均摩尔质量不再改变
②比较A、B、C三点化学反应速率由大到小顺序是__________________。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)=___________L。
(3)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH ="a" KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH ="b" KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式________________________。
一定温度下,在容积固定的V L密闭容器里加入
n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g);ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g);ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)K和x的关系满足K=______ __在保证A浓度不变的情况下,增大容器的体积,平衡__________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(2)若该反应的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:
t2时______ __;t8时______ __;
②t2时平衡向______ __(填“正反应”或“逆反应”)方向移动;
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
W、X、Y、Z分别为H、C、N、O元素。
(1)由XW4、Z2和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为_____________
(2)已知:2YZ2(g)  Y2Z4(g) ΔH<0。在恒温恒容条件下,将一定量YZ2和Y2Z4的混合气体通入容积为2 L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
Y2Z4(g) ΔH<0。在恒温恒容条件下,将一定量YZ2和Y2Z4的混合气体通入容积为2 L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。

①a、b、c、d四个点中,化学反应处于平衡状态的是点___________________。
②25 min时,增加了______________(填物质的化学式)___________________mol。
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_________________(填字母)。
(一)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 。(填“增大”或“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为 。
③在T2温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1。
(二)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=
mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。
(三)已知C(s)+H2O(g)=CO(g)+H2(g)ΔH=akJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
| 化学键 |
H-H |
C-O |
C≡O |
H-O |
C-H |
| E/(kJ·mol-1) |
436 |
343 |
1076 |
465 |
413 |
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=______________mol/(L·min)
CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=______________mol/(L·min)
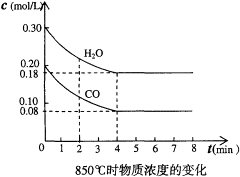
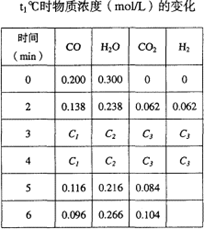
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右上表。请回答:
①表中3min~4min之间反应处于____________状态;C1数值__________0.08mol/L(填大于、小于或等于)。
②反应在4min~5min问,平衡向逆方向移动,可能的原因是____________(单选),表中5min—6min之间数值发生变化,可能的原因是____________(单选)。
a、增加了水蒸气的量 b、降低温度 c、使用催化剂 d、增加氢气浓度
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理基污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)△H=-198kJ•mol-1
2SO3(g)△H=-198kJ•mol-1
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示.
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于 _________________。
②平衡状态由A变到B时.平衡常数K(A)____________K(B)(填“>”、“<”或“=”)
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,放出的热量为:____________kJ