湖北省宜昌示范高中高二市期末化学试卷
化学知识渗透到人类生活的各个方面。下列说法正确的是
| A.为提高农作物的产量和质量,应大量使用化肥和农药 |
| B.油脂和汽油都属于酯类,都能用作工业制肥皂 |
| C.纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
| D.雾霾严重影响了人们的正常生活,为改善空气质量,可以加高工厂的烟囱,使烟尘和废气远离地表 |
分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下列(2)中的物质不能按照对应的分类标准与(1)中的物质归为一类的是
| 选项 |
(1) |
(2) |
分类标准 |
| A |
盐酸、漂白粉、水玻璃、双氧水 |
氨水 |
混合物 |
| B |
CH3COOH、H2CO3、HClO、NH3·H2O |
HF |
弱电解质 |
| C |
电解反应、盐的水解、煤的干馏、石油裂化 |
钢铁生锈 |
化学变化 |
| D |
CO2、SO3、P2O5、SiO2 |
Al2O3 |
酸性氧化物 |
下列关于化学键的说法正确的是
| A.构成单质分子的微粒一定含有共价键 |
| B.全部由非金属元素形成的化合物不一定只含共价键 |
| C.离子化合物中不可能含有非极性键 |
| D.非极性键只存在于双原子单质分子中 |
下列说法正确的是
| A.有机物就是仅由碳、氢两种元素组成的化合物 |
| B.有机物都是非电解质,不能导电 |
| C.组成符合CnHn的有机物分子一定互为同系物 |
| D.含有醛基(-CHO)的有机物不一定是醛 |
下图是立方烷(C8H8)的球棍模型,下列有关说法不正确的是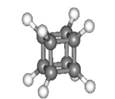
| A.它的一氯代物只有一种同分异构体 |
| B.它的二氯代物有三种同分异构体 |
| C.它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |
| D.它是一种不饱和烃,既能发生取代反应,又能发生加成反应 |
设NA为阿伏加德罗常数的数值,下列叙述中正确的是
| A.3.2 g O2和O3混合气体所含的氧原子总数为0.2 NA |
| B.一定条件下,2 mol SO2和1 mol O2在密闭容器中充分反应后,容器内气体分子总数为2 NA |
| C.12 g金刚石含4 NA个C-C键 |
| D.0.1 mol Na在空气中完全燃烧生成Na2O2,转移的电子数为0.2 NA |
在某酸性溶液中,一定能大量共存的离子组是
| A.Na+、K+、SO42-、HCO3- | B.NH4+、K+、SO42-、Cl- |
| C.Na+、Al3+、AlO2-、NO3- | D.Fe 2+、K+、SO42-、NO3- |
下列实验方案不合理的是
| A.用pH试纸测定氯水的pH |
| B.用焰色反应鉴别NaCl和KNO3 |
| C.用AgNO3溶液鉴别NO2和Br2蒸气 |
| D.用饱和NaHCO3溶液除去CO2中混有的HCl杂质气体 |
某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是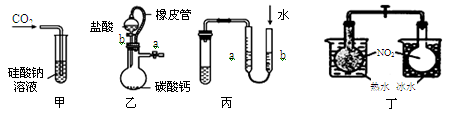
| A.甲装置:可用来证明碳的非金属性比硅强 |
| B.乙装置:橡皮管的作用是保证装置不漏气 |
| C.丙装置:用图示的方法检查此装置的气密性 |
| D.丁装置:探究温度对平衡的影响 |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为31。则下列判断正确的是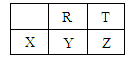
| A.R位于元素周期表中第二周期第ⅣA族 |
| B.原子半径:X<R<T |
| C.最简单气态氢化物稳定性:T>R>Y |
| D.最高价氧化物对应的水化物酸性:T>R>Y |
海洋中资源丰富,以海水为原料可制得一系列产品,如下图所示。下列说法中正确的是
| A.第①步除去粗盐中SO42-、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
B.将第②步结晶出的MgCl2 6H2O在空气中加热分解制备无水MgCl2 6H2O在空气中加热分解制备无水MgCl2 |
| C.在第③④⑤步中溴元素均被氧化 |
| D.电解饱和食盐水时,在阴极区生成NaOH |
下列反应或过程能量的变化符合图示的是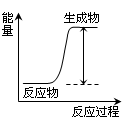
| A.H + H → H—H |
| B.Mg + 2HCl=MgCl2 + H2 ↑ |
| C.2NH4Cl + Ba(OH)2·8H2O=BaCl2+2NH3↑+10H2O |
| D.H2SO4 + 2KOH=K2SO4 + 2H2O |
.根据下列热化学方程式,判断正确的是
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH 1=-Q1 kJ·mol-1
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH 2=-Q2 kJ·mol-1
| A.Q1>Q2 | B.Q1=Q2 | C.ΔH1>ΔH2 | D.ΔH 1<ΔH 2 |
反应2SO2+O2 2SO3(g)经一段时间后,SO3的浓度增加了0.2 mol/L,在这段时间内用O2表示的反应速率为0.01 mol·L-1·s-1,则这段时间为
2SO3(g)经一段时间后,SO3的浓度增加了0.2 mol/L,在这段时间内用O2表示的反应速率为0.01 mol·L-1·s-1,则这段时间为
| A.0.1 s | B.2.5 s | C.5 s | D.10 s |
已知某温度时:N2(g)+3H2(g) 2NH3(g)ΔH=-92 kJ·mol-1。在相同下条件下,向容器中通入1mol N2和3mol H2,达到平衡时放出热量为69 kJ。则N2的转化率为
2NH3(g)ΔH=-92 kJ·mol-1。在相同下条件下,向容器中通入1mol N2和3mol H2,达到平衡时放出热量为69 kJ。则N2的转化率为
| A.25% | B.50% | C.75% | D.无法计算 |
将等物质的量的X、Y气体充入某固定容积的密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g)ΔH<0。当改变某个条件建立新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g)ΔH<0。当改变某个条件建立新的平衡时,下表中关于新平衡与原平衡的比较正确的是
| |
改变条件 |
新平衡与原平衡比较 |
| A |
向容器中充入He气 |
X的转化率变大 |
| B |
增大压强 |
X的浓度变大 |
| C |
充入一定量Y |
Y的转化率增大 |
| D |
使用适当催化剂 |
X的体积分数变大 |
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,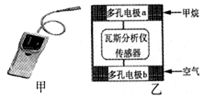
其中的固体电解质是Y2O3—Na2O,O2-可以在其中自由移动。下列有关叙述不正确的是
| A.电极b是正极,内电路中O2-由电极b流向电极a |
| B.电极a的反应式为:CH4 +4O2--8e-=CO2 +2H2O |
| C.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| D.当固体电解质中有1 mol O2- 通过时,电子转移2 mol |
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后(假设溶液体积不变),两极均收集到22.4 L气体(标准状况)。下列说法正确的是
| A.上述电解过程中共转移2 mol电子 |
| B.电解后溶液中c(H+)为4mol/L |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.原混合溶液中c(K+)为1 mol/L |
已知某酸H2B在水溶液中存在下列关系:①H2B H++HB-,②HB-
H++HB-,②HB- H++B2-。则下列关于酸式盐NaHB的说法中一定正确的是
H++B2-。则下列关于酸式盐NaHB的说法中一定正确的是
A.NaHB的电离方程式为:NaHB Na++H++B2- Na++H++B2- |
| B.NaHB溶液一定显碱性 |
C.NaHB和NaOH溶液反应的离子方程式为H++OH- H2O H2O |
| D.NaHB溶液中一定存在:c(Na+)+c(H+)=c(HB-)+2c(B2-)+c(OH-) |
如图为常温下,向25 mL某浓度的 NaOH溶液中逐滴加入0.2 mol·L-1 CH3COOH溶液的过程中溶液pH的变化曲线。下列说法不正确的是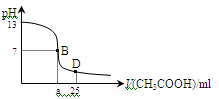
| A.NaOH溶液起始浓度为0. 1 mol·L-1 |
| B.a>12.5 |
| C.B点溶液中c(Na+)一定等于c(CH3COO-) |
| D.D点溶液中: c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
铁、铝、铜及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)铝元素在周期表中位置 ,铝离子的结构示意图为 。
(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性由强到弱的排列顺序是 。制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为 。
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是 (填字母序号)。
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对。 |
| B |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
Ⅰ对;Ⅱ错。 |
| C |
铝粉可以和氧化铁粉末发生铝热反应 |
铝热反应是工业炼铁最常用方法 |
Ⅰ对;Ⅱ错。 |
| D |
铜在潮湿空气中表面会生成铜绿 |
可用铜容器盛放浓硫酸 |
Ⅰ对;Ⅱ对。 |
(5)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为________(填化学式)。
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,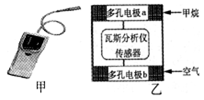
其中的固体电解质是Y2O3—Na2O,O2-可以在其中自由移动。下列有关叙述不正确的是
| A.电极b是正极,内电路中O2-由电极b流向电极a |
| B.电极a的反应式为:CH4 +4O2--8e-=CO2 +2H2O |
| C.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| D.当固体电解质中有1 mol O2- 通过时,电子转移2 mol |
2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,他们开创性的成就使光学显微镜分辨率步入了纳米时代。
Ⅰ.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)实验室若用NH4Cl和熟石灰作试剂来制取、收集干燥的NH3,请选择装置并按气流方向连接各仪器接口 (填装置接口顺序),若要制取、收集干燥的CO2,则需选用上述仪器装置中的 (填装置序号)。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 。试写出制纳米级碳酸钙的离子方程式 。
Ⅱ.纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(3)制备TiO2的常见方法:将TiCl4水解产物加热脱水生成TiO2。已知常温下Ti(OH)4的Ksp=7.94×10-54,测得TiCl4水解后溶液常温下的pH=2,则此时溶液中:c (Ti4+)= 。
(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要右图中的_______(填字母代号)。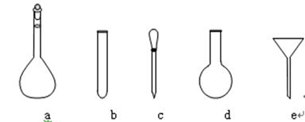
(5)滴定终点的现象是 。
(6)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则试样中TiO2质量分数表达式为 。
Ⅲ.(7)纳米材料具有很多特殊的优良性能,其颗粒大小一般在1~100 nm之间。试设计简单的实验方案,判断Ⅰ、Ⅱ实验中所得样品颗粒是否为纳米级 。
选做SO2、CO、氮氧化物和可吸入颗粒物等都是大气污染物。
(1)比较N、O的第一电离能大小关系为N O(填“>”、“=”或“<”)。
(2)CO易与血红蛋白中Fe2+结合成稳定的配合物而使人中毒。写出Fe基态原子的价电子排布式 ;CO有多种等电子体,写出其中的一种 。
(3)为减轻SO2污染,火力发电厂常在燃煤中加入CaO“固硫”。CaO和NaCl晶胞结构类型相同,则每个Ca2+周围与它最近且等距的Ca2+有 个;CaO晶体的熔点高于NaCl晶体,说明两者晶格能CaO NaCl(填“大于”或“小于”)。
卤族元素的单质和化合物很多,请用物质结构与性质的相关知识回答:
(1)在一定浓度的氢氟酸溶液中,存在(HF)n缔合分子,使HF分子缔合的作用力是___。
(2)ClO4-中心氯原子的杂化方式为_____,离子的立体构型为__________。
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的分子结构分别如图I、II所示:请比较酸性强弱:HIO3_____H5IO6(填“>”、“<”或“=”)。H5IO6分子中σ键与π键的个数比为 。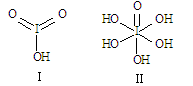
(4)下图为碘晶体晶胞结构。有关说法中正确的是___。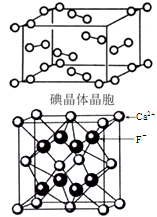
| A.用均摊法可知平均每个晶胞中有4个碘原子 |
| B.碘晶体中分子的配位数为12,具有分子密堆积特征 |
| C.碘晶体中存在的相互作用有非极性键和范德华力 |
| D.碘晶体中碘分子有3种排列方向 |
(5)观察CaF2晶胞结构,判断F-占据Ca2+ 形成的 面体空隙中,Ca2+ 占据F-形成的 面体空隙中。若相邻两个Ca2+ 的核间距为a cm,晶胞密度为ρ g/cm3,NA为阿伏加德罗常数,则CaF2的摩尔质量可以表示为________g/mol。
选做脱羧反应形成新的C-C键,为有机合成提供了一条新的途径,例如: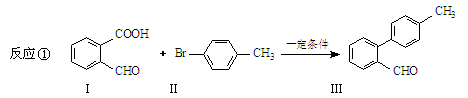
(1)化合物I含有的官能团名称是 , 1 mol化合物I完全加成需要消耗 mol H2。
(2)化合物III与新制氢氧化铜反应的化学方程式为________________________。
(3)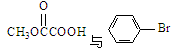 也可以发生类似反应①的反应,有机产物的结构简式为: 。
也可以发生类似反应①的反应,有机产物的结构简式为: 。
(4)化合物I有多种同分异构体,请写出任意2种符合下列条件的同分异构体的结构简式:_ ___。
(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。Ⅰ.用乙炔等合成烃C。
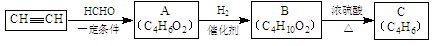
已知:
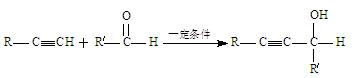
Ⅱ.用烃C、苯合成PMLA的路线如下。
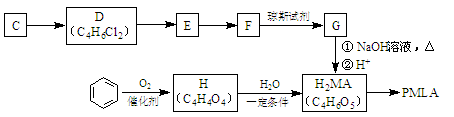
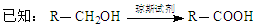
(1)B转化为C的化学方程式是 ;其反应类型是 反应。
(2)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO244.8 L,H有顺反异构,其反式结构简式是 。
(3)G与NaOH溶液在加热条件下反应的化学方程式是 。
(4)在Ⅱ的合成路线中,属于加成反应的一共有 步。
(5)PMLA是由H2MA缩聚而成的聚酯高分子,有多种结构,写出其中任意一种结构简式 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号