(1)某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示。由图中数据分析,该反应的化学方程式为: 。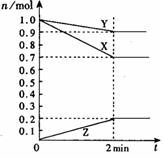
(2)反应开始至2 min,Z的平均反应速率为 。
(3)不同时间测得以下反应速率:
① v(X)="0.075" mol· L-1·min-1
② v(Y)="0.001" mol· L-1·s-1
③ v(Z)="0.06" mol·L-1·min-1
速率由大到小关系正确为
A.①>③>② B.③>①>② C.②>③>①
(12分)一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
(1)该反应的化学方程式是 。
(2)在图上所示的三个时刻中, (填“t1”“t2”或“t3”)时刻处于平衡状态,此时v正 v逆(填“>”“<”或“=”);0- t2时间段内v(N) = 。
(3)已知M、N均为气体,若反应容器的容积不变,则“压强不再改变” (填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是 (选填字母)。
| A.升高温度 | B.降低压强 |
| C.减小M的浓度 | D.将反应容器体积缩小 |
高炉炼铁过程中发生的主要反应为 Fe2O3(s)+CO(g)=
Fe2O3(s)+CO(g)=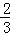 Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求CO的平衡转化率= :
(3)欲提高(2)中CO的平衡转化率,可采取的措施是
A.减少Fe的量
B.增加Fe203的量
C.移出部分C02
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂.
(1)以CO2为碳源制取低碳有机物成为国际研究焦点,下面CO2加氢制取低碳醇的热化学方程式:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ•mol﹣1
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H=﹣173.6kJ•mol﹣1
则2CH3OH(g)=CH3CH2OH(g)+H2O(g) 的反应热△H=
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=﹣221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393.5kJ/mol
试写出NO与CO催化转化成N2和CO2的热化学方程式
(3)在一定温度下,有c(H+)相同盐酸、硫酸、醋酸三种酸,物质的量浓度分别为c1、c2、c3,则三者由大到小的顺序是
(4)对于A+2B(g)⇌nC(g)在一定条件下达到平衡后,增大压强,平衡不移动,若n=2,A的状态为 ;若A为固体,增大压强,C的组分含量减少,则n
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
(1)X的转化率是 ;
(2)由图中所给数据进行分析,该反应的化学方程为 ;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ;
(4)当反应进行到第 min,该反应达到平衡。
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g) 2NH3(g) ΔH <0达到平衡的标志是__________________________(填编号)
2NH3(g) ΔH <0达到平衡的标志是__________________________(填编号)
①反应速率v(N2):v(H2):v(NH3) =" 1" : 3 : 2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)= V(NH3逆)
⑦单位时间内3 mol H—H键断裂的同时2 mol N—H键也断裂
⑧混合气体的平均相对分子质量不再改变
(2)现有八种物质:①干冰;②金刚石;③四氯化碳;④晶体硅;⑤过氧化钠;⑥碳化硅晶体;⑦溴化钠;⑧氖。请用编号填写下列空白:
A.属于原子晶体的是_____________,其中熔点由高到低的顺序为____________
B.属于分子晶体的是_____________________,其中分子构型为正四面体的化合物的电子式为_________________
C.既含有共价键又含有离子键的化合物是_______,其中阳离子个数与阴离子个数之比为_____
在容积固定的密闭容器中,发生反应CO2(g) + H2(g)  CO(g) + H2O(g),化学平衡常数K和温度t的关系如下表:
CO(g) + H2O(g),化学平衡常数K和温度t的关系如下表:
| t/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K = ______________________;
(2)该反应为_________反应(填“吸热”或“放热”。)
(3)能判断该反应达到化学平衡状态的是________(填字母)。
a.容器中总压强不变
b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等
d.c(CO2)= c(CO)
298K时,合成氨反应的反应热△H=-92.4 kJ·mol-1。在该温度下,取1mol N2和3molH2放在一个密闭的容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_______________。
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2 (g)+O2(g) 2SO3(g) +190kJ
2SO3(g) +190kJ
(1)下列描述中能说明上述反应已达平衡的是
| A.V (O2)正="2v" (SO3)逆 |
| B.容器中气体的平均分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中气体的分子总数不随时间而变化 |
(2)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则V (O2) = mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
某温度下,在2 L密闭容器中X、Y、Z三种气体进行反应, 其物质的量随时间的变化曲线如图。
(1)该反应的化学方程式是_____________________。
(2)若t1= 2min, 用X表示0-t1时间段的反应速率为 ___,X的转化率为 _________
(3)在t1 min时,该反应达到了化学平衡状态,下列可作为反应已达到平衡状态标志的是( )(填字母序号)
| A.X、Y、Z的反应速率相等 |
| B.生成3 mol Y的同时生成1 mol Z |
| C.生成1 mol Z的同时生成2 mol X |
| D.容器的压强保持一定 |
E.容器内气体的平均相对分子质量不再改变
(10分)某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析: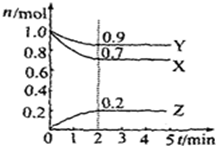
(1)该反应的化学方程式为__ ____.
(2)反应开始至2min,用X表示的平均反应速率为______ mol·L-1·min-1;
平衡时,Y的转化率为__ ____,
平衡时,Z的浓度为___ ___ mol·L-1。
(3)下列叙述能说明上述反应达到平衡状态的是_____ _(填选项、多选)
| A.X、Y、Z的物质的量之比为3:1:2 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗3mol X,同时生成2mol Z |
| D.混合气体的总质量不随时间的变化而变化 |
E.混合气体的总物质的量不随时间的变化而变化.
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)若升高温度,甲醇的生成率减小,则该反应的正反应为__________反应(放热或吸热);
(2)改变下列条件,不能加快化学反应速率的是__________;
a.移走甲醇 b.增大压强
c.扩大容器体积 d.升高温度
(3)写出两个既能加快反应速率,又能使一氧化碳的转化率提高的措施:_______________;______________________________________。
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题: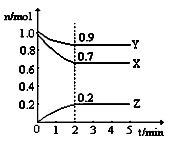
(1)该反的化学反应方程式为 ;
(2)从开始至2miN,Z的平均反应速率是 ;
(3)第4分钟时下列叙述正确的是 ;
| A.该反应已停止 | B.该反应为可逆反应 |
| C.3v(X)=2v(Z) | D.c(X) :c(Y) :c(Z) =" 7" :9 :2 |
下图I中表示在2L的密闭容器中、T1温度下,某可逆反应各物质浓度与时间关系;图II表示当其它条件不变时,C物质的体积分数(C%)与温度(T)和压强(p)的关系。回答下列问题:
(1)该可逆反应的化学方程式为 。
(2)上述反应的压强p1 p2,反应的焓变△H 0(填“大于”、“小于”或“等于”)
(3)若温度T1时,5min后反应达到平衡,则
①平衡时体系总的物质的量为 。
②反应的平衡常数K= 。(列式计算)
③反应在0~5min区间的平均反应速率v(B)= 。
(1)已知: ①CO(g)+2H2(g) CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-1
③CO(g) +H2O(g)  CO2(g)+H2(g) △H3= -41 kJ·mol-l
CO2(g)+H2(g) △H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H=
CH3OCH3(g) +CO2(g) △H=
化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)写出反应②2CH3OH(g)  CH3OCH3(g)+H2O(g)平衡常数的表达式Kc=
CH3OCH3(g)+H2O(g)平衡常数的表达式Kc=
若在某温度下的平衡常数Kc = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c /mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。