已知Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH=a kJ/mol,平衡常数为K;测得在不同温度下,K值如下:
FeO(s)+CO(g) ΔH=a kJ/mol,平衡常数为K;测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)该反应的平衡常数表达式K=______________________
(2)方程式中的a________0(填“大于”“小于”或“等于”)。
(3)700℃上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有__ ______(填序号)
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
在一定温度下,发生反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.7 |
42.9 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH_____0(填“<”、“>”或“=”)
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率为 。
(3)1000℃时,在(2)的平衡体系中,各加0.5molCO和0.5molCO2,v正 v逆(填“<”、“>”或“=”),平衡向 移动(填“正向”、“逆向”或“不移动”)。
分一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

(1)反应开始到平衡,用Z表示的反应速率为 mol·L-1·s-1,Y的转化率 。
(2)该反应的化学方程式为 。
(3)10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:
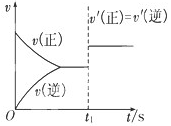
则下列说法符合该图像的是________________。
| A.t1时刻,增大了X的浓度 |
| B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 |
| D.t1时刻,使用了催化剂 |
分工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g) 2NH3(g),△H=﹣92.44kJ/mol;回答下列问题:
2NH3(g),△H=﹣92.44kJ/mol;回答下列问题:
①写出该反应的化学平衡常数表达式:K= .随着温度的升高,K值 。(填增大、减小、不变).
②平衡常数K值越大,表明 (填序号).
| A.N2的转化率越高 | B.NH3的产率越大 |
| C.原料中N2的含量越高 | D.化学反应速率越快 |
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化关系曲线如图所示。
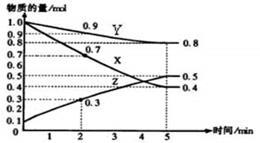
(1)由图中的数据分析,该反应的化学方程式为 ___________
(2)反应开始至2min、5minZ的平均反应速率为 、 ;
(3)5min后Z的生成速率比5min末Z的生成速率 (填写“大、小或相等”)。
研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=_____________mol,NO的转化率α1=_____________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2_____________α1(填“>”“<”或“=”),平衡常数K2___________(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是____________。
反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是 反应(填“吸热”、“放热”).
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”、“不变”),原因是
(3)反应体系中加入催化剂对反应热是否有影响? (填“有”、“无”),原因是 .
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”、“减小”、“不变”).
(10分,每空2分)在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g)⇌xC(g)+2D(g),2min末反应达到平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L.由此推断:
(1)x值等于
(2)B的平衡浓度为
(3)A的转化率为
(4)生成D的反应速率
(5)如果增大反应体系的压强,则平衡体系中C的质量分数 (填“增大”或“减小”或“不变”)
在一体积不变的密闭容器中进行如下反应:2X(g)+Y(g)  2W(g);反应前按n(X)∶n(Y)=3∶1加入反应物,反应过程中W的物质的量随时间的变化如图所示。
2W(g);反应前按n(X)∶n(Y)=3∶1加入反应物,反应过程中W的物质的量随时间的变化如图所示。
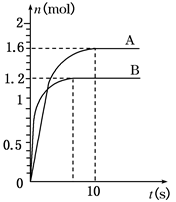
(1)分析曲线A和B的不同,可能是以下_____ ___原因造成的。
A.是否使用催化剂 B.反应温度不同
C.外界的压强不同 D.初始充入的反应物的物质的量不同
(2)该反应的化学平衡常数为K,比较K500℃___ _____K600℃(填“>”、“<”或“=”)。
(3)如果曲线B达到平衡时,体系的压强为反应前的85%,当容器的体积为1 L时,计算:曲线A从开始达到平衡,X的反应速率v(X)为____________。起始时加入Y的物质的量为______________mol。不通过计算能否判断出X、Y转化率是否相同_________________(填“能”或“否”)。
(4)说明该反应已达到平衡状态的是_________________。
A.v正(W)=v逆(W) B.c(X)=c(W)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(10分,每空2分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol-1
2SO3(g) ΔH=−196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=−113.0 kJ·mol-1
2NO2(g) ΔH=−113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(10分,每空2分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:
SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,不正确的 (选填编号)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。
( 16分)一定温度下,将3 molA气体和1 molB气体通入一密闭容器中,发生如下反应:3A(g)+B(g)  xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)若容器体积固定为 2 L,反应1 min 时测得剩余1.8 mol A,C的浓度为0.4 mol/L。
①1 min内,B的平均反应速率为__ ______;x为________。
②若反应经2 min达到平衡,平衡时C的浓度________0.8 mol/L(填“大于”、“等于”、“小于”)
③平衡混合物中,C的体积分数为22%,则A的转化率是____ ____。
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的量n(A)、n(B)、n(C)之间应满足的关系式:______ ______。
(2)若维持容器压强不变
①达到平衡时C的体积分数________22%,(填“大于”、“等于”、“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2 倍,则应加入________mol A气体和 ________mol B气体。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1 <0(I)
NaNO3(s)+ClNO(g) K1 ΔH1 <0(I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2 <0(II)
2ClNO(g) K2 ΔH2 <0(II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
(用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应(II)达到平衡。
测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途。
(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1
H2O2(l)===H2O(l)+ O2(g),ΔH=-98 kJ·mol-1
O2(g),ΔH=-98 kJ·mol-1
H2O(l)===H2O(g),ΔH=+44 kJ·mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式_________________________。
(2)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g) NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示。由图可得出的正确说法是________________。
NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示。由图可得出的正确说法是________________。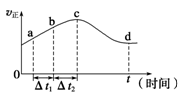
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+ O2(g) 2SO3(g),△H<0
2SO3(g),△H<0
(1)写出该反应的化学平衡常数表达式K= 。
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速度 (以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。

(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)。10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量