在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如下图,据图回答下列问题:
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为 。
(2)根据右图写出该反应的化学方程式 。
(3)第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应是 (填“放热”或“吸热”)反应。若在第7分钟时增加D的物质的量,A的物质的量变化正确的是_____(用图中a~c的编号回答)
(4)某同学在学习了“化学反应速率和化学平衡”专题后,发表如下观点,你认为错误的是 。
a.化学反应速率理论是研究怎样在一定时间内快出产品
b.化学反应速率理论是研究怎样提高原料转化率
c.化学平衡理论是研究怎样使用有限原料多出产品
d.正确利用化学反应速率和化学平衡理论都可以提高化工生产的综合效益
(1)在密闭容器中有H2O(g) +C(s)  CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸汽浓度,平衡向 反应方向移动(填“正”、“逆”或“不”下同),CO的浓度将 。(填“增大”、“减小”或“不变”下同)
CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸汽浓度,平衡向 反应方向移动(填“正”、“逆”或“不”下同),CO的浓度将 。(填“增大”、“减小”或“不变”下同)
②增加H2浓度平衡向 反应方向移动,CO的浓度将 。
(2)用注射器吸入少量NO2和N2O4的混合气体,发生如下反应:
2NO2(g) N2O4(g) 当活塞迅速向外拉时,平衡向 反应方向移动,气体的颜色先变_____(“浅”、“深”或“不变”下同),后变______;最终和最初相比,_____更深(填“前”或“后”)。
N2O4(g) 当活塞迅速向外拉时,平衡向 反应方向移动,气体的颜色先变_____(“浅”、“深”或“不变”下同),后变______;最终和最初相比,_____更深(填“前”或“后”)。
T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6mol A和3mol B,发生反应如下:3A(g)+b B(g) 3C(g)+2D(g),
3C(g)+2D(g), ;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
;4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。根据题给的信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=_________,化学方程式中计量数b=________。
(2)乙容器中反应达到平衡所需时间t_________4min(填“大于”、“小于”或“等于”),原因是___________________________________________________________。
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8mol/L,起始时,向丙容器中加入C、D的物质的量分别为3mol、2mol,则还需加入A、B的物质的量分别是___________、___________。
某温度时,把1mol/LN2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
(1)前4s中以N2O4的浓度变化表示的平均反应速度为 mol/L·s。
(2)在4s时容器内的压强为开始时的 倍。
(3)在平衡时容器内含N2O4 mol。
(4)在平衡时容器内NO2的浓度为 mol/L。
(5)N2O4的转化率为 。
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示:
(1)该反应的化学方程式为: 。
(2)反应开始至10s末,X的平均反应速率为: 。
(3)若在第10s时分离出部分Y,则容器中X的物质的量会________(填“增大”、“减小”或“不变”)。
 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
 (1)图中A、C分别表示 、
(1)图中A、C分别表示 、
,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是
 (2)图中△H= KJ·mol-1;
(2)图中△H= KJ·mol-1; (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式 、 。
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式 、 。 (4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=
在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应: 3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。
3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。
⑴B的平衡浓度为 。
⑵A的转化率为 。
⑶用D表示的平均反应速率为 。
⑷如果缩小容器容积(温度不变),则平衡体系中混合气体的密度 、平均相对分子质量 。(两空均填“增大、“减少”或“不变”)
在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(已知气体的分压之比等于物质的量之比)。
⑴ 420K时,发生反应的化学方程式为:
________________________________________,
若反应中消耗1 mol Xe,则转移电子______mol。
⑵ 600~800K时,会发生反应:
XeF6(g)  XeF4(g) + F2(g) , 其反应热
XeF4(g) + F2(g) , 其反应热
△H________0(填“>”、“=”或“<”),理由是__________________________________________。
⑶ 900K时,容器中存在的组分有 。
现有反应:CO(g)+ H2O(g) CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K____1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2和 x molH2,则:
①当x=5.0时,上述平衡向_______(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大小”、“小于”或“等于”)。
在0.5L的密闭容器中,一定量的氮气和氢气进行
如下化学反应:N2(g)+3H2(g) 2NH3(g) ⊿H<0,其化学平衡常数K与温度t的关系如右表:
2NH3(g) ⊿H<0,其化学平衡常数K与温度t的关系如右表:
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
请完成下列问题;
(1)试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
(2)下列各项能作为判断该反应达到化学平衡状态 的依据是 (填序号字母)
的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.υ(N2)正=3υ(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)400℃时,反应2NH3(g)  N2(g)+3H2(g)的化学平衡常数的值为 。
N2(g)+3H2(g)的化学平衡常数的值为 。
当测得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,则该反应的
υ(N2)正 υ(N2)逆 (填写“>”、“=”或“<”)
(4)(3)中反应平衡时,升高温度,NH3转化率 (填“变大”、“变小”、“不变”)
前不久报道,我国“煤变油”技术已进入世界先进行列,科学家通过不懈努力,找到了 (由煤和水蒸气高温制得)应用的新方法,如:
(由煤和水蒸气高温制得)应用的新方法,如:
(1)合成汽油: 和
和 在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。
在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。
①写出 CO合成汽油 的化学方程式
的化学方程式
②若向密闭的合成塔里通入恰好能完全反应的CO和 ,当完全反应时,气压降至原来的2/5,(温度不变),此时 (填“有”或“没有”)汽油生成,理由是
,当完全反应时,气压降至原来的2/5,(温度不变),此时 (填“有”或“没有”)汽油生成,理由是
③要达到上述合成汽油的要求,CO和 的体积比的取值范围是
的体积比的取值范围是
(2)合成甲醇:在390°C、3.03×105Pa时, ,以n表示
,以n表示 和
和 的物质的量之比,a表示
的物质的量之比,a表示 的转化率,x表示达到反应限度时混合物中
的转化率,x表示达到反应限度时混合物中 的体积分数,则
的体积分数,则 、a、x的关系式为 。
、a、x的关系式为 。
t℃时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2(g) +O2(g)  2 SO3(g);ΔH = -196.6 kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mo1。请填写下列空白:
2 SO3(g);ΔH = -196.6 kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mo1。请填写下列空白:
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)_________
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化2
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为_____________;反应放出的热量为 kJ。
(3)该条件下反应平衡常数为__________________。
(4)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是_________________
A.向容器中通人少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图所示,其中t1~t2速率变化的主要原因是_________;t2~t3速率变化的主要原因是_________。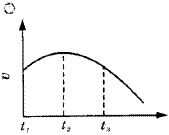
氢气发生速率变化曲线
537℃、1.01×105Pa 时,往容积可变的密闭容器中充入2mol SO2、 1mol O2,此时容器的体积为200L。向容器中加入催化剂(固体)并保持恒温恒压,发生反应:
2SO2(气)+O2(气) 2SO3(气)
2SO3(气)
达到平衡时,平衡气体中SO3的体积分数为0.91。
试回答下列问题:
(1)工业上二氧化硫的催化氧化采用常压而不采用高压的原因是: _______。
(2)保持上述温度和压强不变,若向容器中只充入2mol SO3并加入固体催化剂。则平衡时,SO2的体积分数是 ,容器的体积为 L。
(3)温度仍保持537℃,容器体积保持200L不变(恒容)。充入a molSO2、b molO2,并加入固体催化剂,反应达平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105Pa。若a:b=2:1,则a= 。