25°C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(m ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。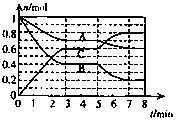
(1)根据上图数据,写出该反应的化学方程式: ;此反应的平衡常数表达式K= ,从反应开始到达第一次平衡时的平均速率v(A)为 。
(2)在5—7min内,若K值不变,则此处曲线变化的原因是
(3)下图表示此反应的反应速率v和时间t的关系图: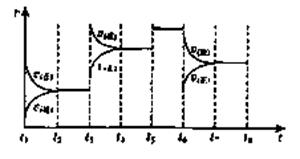
各阶段的平衡常数如下表所示:
 |
 |
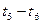 |
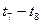 |
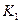 |
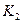 |
 |
 |
K1、K2、K3、K4之间的关系为: (用“>”、“<”或“=”连接)A的转化率最大的一段时间是
(每小题3分,共9分)恒温恒压下,在一个容积可变的密闭容器中发生如下反应: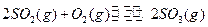
(1)若开始时通入 ,达平衡时生成
,达平衡时生成 的转化率为 。
的转化率为 。
(2)若开始时通入 ,达平衡时SO2的物质的量为 mol。
,达平衡时SO2的物质的量为 mol。
(3)若在(2)的平衡混合物中再通入bmol SO3,则达到平衡时SO3的体积分数是 。
(每空3分,共9分)在一定条件下,反应 达到平衡。
达到平衡。
(1)若A、B、C都是气体,在增压后平衡向逆反应方向移动,则,y,之间的关系是 。
(2)若C是气体,且+y=,在增大压强时,如果平衡发生移动,则A的转化率将 (填“增大”、“减小”或“不变”)
(3)若A为固体,B、C为气体,且y>,则增大压强时混和气体的平均相对分子质量将 (填“增大”“减小”或“不变”)
某温度时,在2L容器中X、Y、Z三种气体及N物质的物质的量(n)随着时间(t)变化的曲线如图所示。
 由图中数据分析:
由图中数据分析:

 (1)物质N在反应中的作用是 。
(1)物质N在反应中的作用是 。
(2)该反应的化学方程式为 。 (3)反应开始至2min,用Z表示的平均反应速率为 。
(3)反应开始至2min,用Z表示的平均反应速率为 。 (4)下列叙述能说明上述反应达到平衡状态的是________ _______(填序号)
(4)下列叙述能说明上述反应达到平衡状态的是________ _______(填序号)
A.混合气体的压强不随时间的变化而变化 |
B.单位时间内每消耗3 mol X,同时生成2 mol Z |
C.混合气体的总质量不随时间的变化而变化 |
D.混合气体的总物质的量不随时间的变化而变化 |
在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下
CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下 表:
表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。该反应为 反应(选填“吸热”、“放热”)。
(2)能判断该反应是否达到化学平衡状态的依据是 。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c) 逆(H2)=
逆(H2)= 正(H2O) (d)c(CO2)=c(CO)
正(H2O) (d)c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积。平衡 移(选填“向正反应方向”、“向逆反应方向”、“不”)
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,CO的转化率为 。
在一定条件下,反应3A(g) + B  2C +2D达到平衡
2C +2D达到平衡
(1)若升高温度,平衡向正反应方向移动,则逆反应是___________(填“吸热”或“放热”)反应,逆反应速率____________(填“增大”或“不变”或“变小”)
(2)若增加或减少B时,平衡不移动,则B是__________态。
(3)若增大压强,平衡向逆反应方向移动,则可判断:B是___态,C是___态,D是__态
已知在催化剂存在条件下,能发生如下反应:
CO + H2O(g)  H2 + CO2 + Q
H2 + CO2 + Q
(1)在5 L盛有固体催化剂(其体积可忽略不计)的密闭容器中,通入反应物,10 s后,生成了氢气0.2 g,则此10 s内CO的平均反应速率为v(CO) = ____ _0.002 mol/Ls______。
(2)在该密闭容器中,下列叙述可以说明反应已经达到平衡状态的是__ BC___
A.若容器体积不变,在一定温度下压强达到恒定
B.CO2的生成速率与H2O蒸气的生成速率之比为1 : 1
C.CO、H2O、H2、CO在容器中的物质的量浓度保持不变
D.反应体系中混合物的平均摩尔质量保持不变
(3)在上述反应达平衡状态后,分别改变条件,请完成下列两张图:
A.在第20 s时将容器体积缩小至 B.在第20 s时,向容器中注入少量的
原来的一半后压强变化图 CO气体后正逆反应速率变化图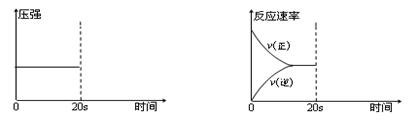
在某温度下合成氨:N2+3H2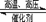 2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
(1)写出该反应的平衡常数表达式:_____________,KA_____ _KB(填“>”、“<”或“=”)。
_KB(填“>”、“<”或“=”)。
(2)平衡常数K值越大,表明建立平衡时__________。
A.N2的转化率越低 B.NH3的产量越小
C.正反应进行得越彻底
(3)欲增大该反应K值,可以采取的措 施为__________。
施为__________。
A.升高温度 B.降低温度
C.增大N2、H2的浓度 D.使用高效的催化剂
(4)分析下表中数据后,完成下列问题[M(平)表示平衡 时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占
时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占 的比例较大。
的比例较大。
| |
容器A |
容器B |
| M(平) |
20 |
|
| 平衡时N2的转化率 |
|
10% |
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ;
(2)反应开始至2min,气体Z的平均反应速率为 ;
(3)若X、Y、Z均为气体,反应达平衡时,此时容器内的压强与起始压强之比为 。
(10分)下图是某温度下,在2L容器中某可逆反应X、Y、Z三种物质的浓度与时间的关系图,根据图中信息回答下列问题:
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)用X表示的化学反应速率为 mol/(L·min),如果升高温度,达到平衡时的时间会变 (填长、短、不能确定或不变)
(3)5min后Z的生成速率 5min时Z的生成速率(填大于、小于或等于)。
(4)达到平衡时X的转化率为 ;
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)  2NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
2NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
  |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)求b、e的值:b= ,e=
(2)计算20s—40s内用N2O4表示的平均反应速率为 ;80℃该反应的化学平衡常数K为
(3)改变条件并达到新平衡,要使NO2在平衡体系中的含量变小,可采取的措施有(填序号) 。
| A.向混合气体中再通入N2O4 | B.保持容积不变,通入He |
| C.使用高效催化剂 | D.降低温度 |
(4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”)
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B)="0.200" mol/L及c(C)="0" mol/L。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件是:②_______________;③_______________。
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________。
(3)该反应的正反应是 (填“放热”或“吸热”)反应。
(4)实验③前10.0 min内平均反应速度率vB=__________________。
(15分)向一个体积可变的密闭器中充入4molA、1molB,发生如下反应:
4A(g)+B(s)  3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
请填写下列空白:
(1)若容器体积为10L,反应经2min达平衡,则以A物质浓度变化表示的化学反应率为
。
(2)若压缩容器增大压强,则逆反应的速率 ,容器中D的体积分数 。(填“增大”“减小”“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减少,则正反应 。(填“吸热”或“放热”)
(4)在最初的容器改充1.5molC、4.4molD温度保持不变,要使反应达平衡时D的浓度为0.6mol·L-1,则容器的体积是 L。
(7分)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式为: ;
(2)反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是: 。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2 (g) + O2(g) = 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g) = 2CO2 (g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式 。
(3)在25℃下,向浓度为0.1 mol·L-1的AlCl3溶液中逐滴加入氨水,生成该沉淀的离子方程式为______________________________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为中性,则
Va︰Vb= 。
(6)在25℃下,将a mol·L-1的氨水 与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);