在一固定容积的密闭容器中,在一定条件下进行以下化学反应:A(g)+2B(g) 3C(g)。已知加入1 mol A和3 mol B,且达到化学平衡后,生成了a mol C。
3C(g)。已知加入1 mol A和3 mol B,且达到化学平衡后,生成了a mol C。
(1)达到化学平衡时,C在反应混合气中物质的量百分含量为_________(用字母a表示)。
(2)在相同实验条件下,若在同一容器中改为加入2 mol A和6 mol B,达到化学平衡后,C的物质的量为________mol(用字母a表示)。此时C在反应混合气体中的物质的量的百分含量_________(填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,并要求达到化学平衡后C在反应混合气体中的百分含量不变,则还应加入C_________mol。
下图表示在密闭容器中反应:
2SO2+O2 2SO3 △H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c~d处.
2SO3 △H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c~d处.
某温度下H2(g)+I2(g)  2HI(g)的平衡常数是50,在该温度下只充入H2与I2(g)发生反应,反应开始时,碘蒸气的浓度是1mol·L-1,当达到平衡时c(HI)=0.9mol·L-1,求H2的转化率?(保留三位有效数字)
2HI(g)的平衡常数是50,在该温度下只充入H2与I2(g)发生反应,反应开始时,碘蒸气的浓度是1mol·L-1,当达到平衡时c(HI)=0.9mol·L-1,求H2的转化率?(保留三位有效数字)
将4molSO2和2molO2的混合气体置于体积可变的恒压容器中,在一定条件下发生如下反应2SO2(g)+ O2(g) 2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
(1)在该平衡时,n(SO3)= mol
(2)若起始时加入1.2molSO2、0.6molO2和xmolSO3,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加SO3的物质的量 |
已知:合成氨反应为N2+3H2 2NH3(正反应为放热反应),分析下列问题:
2NH3(正反应为放热反应),分析下列问题:
(1)在一定温度时,可用图中哪一条曲线表示反应物的转化率和压强之间的关系 (填“I”“II”“III”)
(2)在不同温度和压强下(P1>P2),合成氨反应达到平衡时,混合气体中氨气的体积分数Z%
随温度变化的曲线应为 (填“A”“B”“C”“D”)
(3)将N2和H2按1:3的体积比通入合成塔,反应达平衡后,NH3的体积分数为20%,则达到平衡时,N2和H2的转化率之比α(N2)∶α (H2)= ;平衡时N2的转化率为_________;平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =
某反应的平衡常数表达式为 ,恒容时,温度升高.H2浓度减小。分析下列问题:
,恒容时,温度升高.H2浓度减小。分析下列问题:
(1)该反应的化学方程式为:
(2)温度升高,该反应的K值______________(填“增大”“减小”或“不变”),化学平衡移动后达到新的平衡,CO2和CO体积比_______________(填“增大”“减小”或“不变”)。
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K= 
(4)850℃时,在相同容器中发生反应CO2+ H2 CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正) v(逆)(“大于”“ 小于”“等于”)
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正) v(逆)(“大于”“ 小于”“等于”)
(1)相同温度时,向两个开始体积相同的容器中分别充入2molSO2和1molO2,甲容器保持恒压,乙容器保持恒容,达到平衡时:(填“大于“小于”“等于”)
反应速率v甲_____ v乙,SO2的转化率ω甲_____ω乙,所需时间t甲____t乙。 (2)在容积相同的两个密闭容器A和B中,保持温度为423K,若同时分别向A和B中加入amol和2amol的HI气体,待反应:2HI(g) H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”)
(2)在容积相同的两个密闭容器A和B中,保持温度为423K,若同时分别向A和B中加入amol和2amol的HI气体,待反应:2HI(g) H2(g)+I2(g)均达到平衡时:(填“大于“小于”“等于”)
I2的浓度c(I2)A____c(I2)B, ,I2蒸气在混合气体中的体积分数A容器_ _B容器
将3 mol A和2.5 mol B混合于2L的密闭容器中,发生反应的化学方程式为:
3A(气) + B(气)  xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 试计算:
xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 试计算:
(1)x = A 的平均反应速率
(2) 平衡时C的浓度
(3) 平衡时B的转化率
(4) 平衡时,容器内的压强与原容器内压强的比值
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):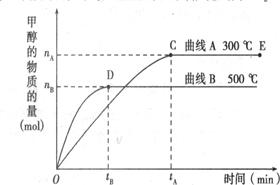
根据题意完成下列各题:
⑴反应达到平衡时,平衡常数表达式K=
升高温度,K值 (填“增大”“减小”或“不变”)。
⑵5000C ,从反应开始到平衡,氢气的平均反应速率v(H2)= (用nB、 tB 表示)
⑶在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,下列有关该体系的说法正确的是
a .氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
⑷可逆反应:CO(g)+ 2H2(g) CH3OH(g)在恒容密闭容器中反应,达到平衡状态的标志是:
CH3OH(g)在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成2n molH2的同时生成n mol CH3OH
②单位时间内生成2n molH2的同时,生成n mol CO
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1 : 2 : 1的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
⑸据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
(10分) 容积固定的密闭容器中,发生可逆反应:M(g)+N(g)  2P(g)+Q(g) ΔH>0,
2P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N 的浓度是 ,P 的体积分数为_________。
(2)若反应温度升高,M的转化率____________ (填“增大”“减小”或“不变”,下同),平均相对分子质量____________,混合气体密度____________。
Ⅰ.在一定温度下,把2 mol N2和6 mol H2通入一个体积不变的密闭容器中(如图)发生以下的反应:
N2(g)+3 H2(g) 2NH3 (g) (正反应为放热反应)
2NH3 (g) (正反应为放热反应)
若反应达到平衡后,测得混和气体为7 mol ,据此回答下列问题:保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a="1" mol ,c="2" mol ,则b="____" mol,在此情况下,反应起始时将向 方向进行(填 “正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是 。
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施是
Ⅱ.如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2 SO2(g)+O2(g) 2 SO3(g)。根据下列要求填写空白:
2 SO3(g)。根据下列要求填写空白:
(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA,B中压强为PB,则PA与PB的关系是PA PB(填“<”、“=”、“>”)。
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在 处。
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol , 则x和y 的关系是x y. (填“<”、“=”、“>”)。
有两个起始体积相同的密闭容器A和B, A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比
A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比
为2 ∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在
∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在
400℃条件下发生反应2SO2+O2 2SO3,并达到平衡。
2SO3,并达到平衡。
⑴ 达到平衡所需时间,A容器比B容器_______,两容器中SO2的转化率A比B______。
⑵ 达 到⑴所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡________移动
到⑴所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡________移动 。
。
⑶ 达到⑴所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数________,B容器中SO3的体积分数__________(填变大、变小、不变)。
(12分)已知2A2(g)+B2(g)  2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
容积的容器中加入2 molA2和1 molB2,在5 00℃时充分反应,达平衡后C3的浓度为
00℃时充分反应,达平衡后C3的浓度为
w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平 衡后,吸收热量Q3
衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。
kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。
(2)能说明该反应已经达到平衡状态的是 。
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容 器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
在密闭容器中,当合成氨的反应N2+3H2===2NH3(正反应是放热反应)达到平衡时,改变如下的一些条件:
| A.升温, | B.加压, | C.减压, | D.增大c(H2),(E)减小c(NH3),(F)增大c(NH3),若平衡向右移动用“ →”,若平衡向左移动用“←”表示;若值增加用“↑”表示,若值减小用“↓”表示,请根据下表中各项的变化情况,在改变条件栏目中填上相应的编号(每项只改变一个条件)。 |
| 编号 |
改变条件 |
平衡移动方向 |
N2的转化率 |
C(NH3) |
C(N2) |
C(H2) |
| ① |
|
→ |
↑ |
↓ |
↓ |
↓ |
| ② |
|
← |
↓ |
↓ |
↑ |
↑ |
| ③ |
|
→ |
↑ |
↑ |
↓ |
↑ |
| ④ |
|
← |
↓ |
↓ |
↓ |
↓ |
| ⑤ |
|
→ |
↑ |
↑ |
↑ |
↑ |
CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g)  kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g)  kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的 。
。
(2)在10L密闭容器中充有10 molCO 与20molH2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)  CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率( )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。