(8分)将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min).试求:
xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min).试求:
(1)此时A的浓度c(A)=________mol/L,x的值为________;
(2)反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol;
(3)平衡时n(A): n(B): n (C): n(D) =
一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为:
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
| A.容器中气体的平均相对分子质量不随时间而变化 | B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 | D.容器中总的物质的量不随时间而变化 |
E. 消耗n mol H2的同时消耗n mol CO
(Ⅱ)某高温下,若该5 L密闭容器中加入的是2molFe(s)与1.00mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.50mol 。
(1) t1~t2这段时间内的化学反应速率v(H2)= 。
(2)计算该可逆反应t2达到平衡时的K值。(要求写出计算过程)
(3)该反应的逆反应速率随时间变化的关系如右图。t1时改变了某种条件,改变的条件可能是 、 。(填写2项)
在4L体积不变的密闭 容器中充入6molA气体和5molB气体,发生反应:
容器中充入6molA气体和5molB气体,发生反应:
3A (g) + B (g)  2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
(1) x= 。
(2) 用B表示的2分钟内的平均反应速率______________________。
(3)达到平衡时 ,在相同温度下容器内混合气体的压强与反应前压强比为 。
,在相同温度下容器内混合气体的压强与反应前压强比为 。
(4)达到平衡状态时B的转化率为 。
已知 :N2(g)+3H2(g)  2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。
(1) 在500℃、2.02×107Pa和铁催化条件下2L密闭容器中充入1molN2和3mol H2,10 min时达到平衡,有0.2 mol NH3生成,则10 min内用氢气表示的该反应的平均速率v(H2)为 ,H2的转化率为__________。
(2)充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是
 。
。
(3)为有效提高氢气的转化率,实际生产中宜采取的措施有____________
| A.降低温度 | B.不断补充氮气 | C.恒容下充入He来增大压强 |
| D.升高温度 E.原料气不断循环 F.及时移出氨 |
(4)氨催化氧化制NO在热的铂铑(Pt-Rh)合金催化下进行,反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为________________ ,当升高温度时,K值______(填“增大”、“减小”、“不变”)。NH3转化率在温度T1下随反应时间(t)的变化如右图:其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下NH3转化率随反应时间变化的预期结果示意图。
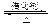 2SO3(g)。
2SO3(g)。 2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。容器 |
SO2(mol) |
O2(mol) |
SO3(mol) |
热量(kJ) |
甲 |
2 |
1 |
0 |
Q1 |
乙 |
1 |
|
0 |
Q2 |
丙 |
0 |
0 |
1 |
Q3 |
 2 < Q3 < 197kJ
2 < Q3 < 197kJ

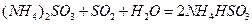
 提高燃煤烟气中
提高燃煤烟气中
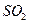 去除率的有 (填字母)。
去除率的有 (填字母)。
目前工业上有一种方法是用CO2来生产燃料甲醇。
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
在体积为1 L的密闭容器中,充入1mol CO2和4 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)。
(2)该反应的平衡常数表达式为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 |
B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1 mol CO2和4 mol H2 |
(4)如果在相同的容器中事先充入1 mol CH3OH和1 mol H2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为 。
mol CH3OH和1 mol H2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为 。
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)
2SO2(g) +O2(g)
+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,
 (填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,
请写出工业合成氨的热化学反应方程式: 。
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白 色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
| 难溶物 |
Ksp |
| Ca3(AsO4)2 |
6.8× 10-19 10-19 |
| AlAsO4 |
1.6×1 0-16 0-16 |
| FeAsO4 |
5.7×10-21 |
| 污染物 |
H2SO4 |
As |
| 浓度 |
28.42 g/L |
1.6 g·L-1 |
| 排放标准 |
pH 6~9 |
0.5 mg·L-1 |
表1.几种砷酸盐的Ksp 表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= ▲ mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ▲ ,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是 ▲ mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 ▲ 。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ▲ ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 ▲ 。
(1) 反应: 2A(g) B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________.
B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________.
(2) 在容积相同的两密闭容器A和B中, 保持温度为 423K, 同时向A和B中分别加入 a mol 和 b mol 的HI(a > b), 待反应: 2HI(g) H2(g)+ I2(g)到平衡后, 用 “ > < 或 ="”" 回答下列问题:
H2(g)+ I2(g)到平衡后, 用 “ > < 或 ="”" 回答下列问题:
从反应开始到达到平衡所需要时间: tA _______ tB(填>,<, =", " 下同)
平衡时的碘的浓度: c(I2 )A c(I2 )B
HI的平衡分解百分率为:  .
.
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=-196.6kJ/mol. 2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
2SO3(g),△H=-196.6kJ/mol. 2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2转化率为 。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同) 。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是 。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为 。
可逆反应的特点是同一反应,能同时向相反的两个方向,充分反应后最终各种物质共存在一起。现将0.2molSO3放在某密闭容器中加热使其分解:2SO3 2SO2+O2。
2SO2+O2。
(1)容器中SO2与O2分子数目比为___________,质量比为__________
(2)最终容器内硫原子与氧原子个数比为__________
(3)反应中,气体分子数目_________(填增加、减少、不变),将充分反应后的混合气体通入适量的BaCl2溶液中,生成的沉淀是_____________;若是通入到足量的NaOH 溶液中,则生成的盐化学式为________________________
中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性.在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡:
H2O+H2O H3O++OH- ΔH>0
H3O++OH- ΔH>0
现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母).
| A.向水中加入NaHSO4 |
| B.向水中加入Na2CO3 |
| C.加热水至100℃[其中c(H+)=1×10-6 mol/L] |
| D.在水中加入(NH4)2SO4 |
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,溶液呈 性(填“酸”、“碱”或“中”);若用pH计测定,则pH 7(填“>”、“<”或“=”),溶液呈 _性(填“酸”、“碱”或“中”).
(I)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,
C(CO32-)/C(SO42-)= 。[已知KspBaSO4=1.3ⅹ10-10,KspBaCO3=2.6ⅹ10-9]
(II)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g) H =-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
N2O4(g) H =-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其它条件不变时,下列措施能提高NO2转化率的是 。
N2O4(g)达到平衡。其它条件不变时,下列措施能提高NO2转化率的是 。
| A.减小NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
(2)25 ℃时,1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则反应2N2H4(l)+N2O4(l) = 3N2(g)+4H2O(l)的H = kJ·mol-1。
(3) 17 ℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,
c(NO2) =" 0.0300" mol·L-1、c(N2O4) =" 0.0120" mol·L-1。 则反应2NO2(g) N2O4(g)的
N2O4(g)的
平衡常数K = 。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2混合气体(17 ℃、1.01×105 Pa),理论上至少需消耗Cu 克。
向2L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:
xA(g)+yB(g) pC(g)+qD(g) 已知:平均反应速率
pC(g)+qD(g) 已知:平均反应速率 ;反应2 min时A的浓度减少了a/6 mol/L,B的物质的量减少了
;反应2 min时A的浓度减少了a/6 mol/L,B的物质的量减少了 mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,VA= ,vB=
(2)化学方程式中,x= y= p= q=
(3)反应达到平衡时,D为2a mol,则B的转化率为
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1. 5a mol则该反应的
△H 0;(填“>、<或-”)
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:①反应速率 (填:“增大”“减小或“不变”)。理由是_
②平衡时反应物的转化率 (填:“增大”“减小”或“不变”)理由是
恒温、恒压下,在一个可变容积的容器中发生如下发应:
2 A(g)+ B(g) 2 C(g)
2 C(g)
(1)若开始时放入2 mol A和1 mol B,到达平衡后,生成a mol C,这时A的物质的
量为 mol。
(2)若开始时放入6 mol A和3 mol B,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x mol A,2 mol B和2 mol C,到达平衡后,A和C的物质的量分别是y mol和3 a mol,则x= mol。
(4)若在(3)的平衡混合物中再加入1 mol C,待再次到达平衡后,C的物质的量分数是 。