四川省泸州天立学校高二上学期期中考试化学试卷
可用在实验室里制取氨气的方法是
| A.在浓氨水中加固体NaOH加热 |
| B.NH4Cl溶液和NaOH溶液混合 |
| C.加热分解NH4Cl晶体 |
| D.加热消石灰和NH4Cl的固体混合物 |
下列物质检验或提纯,其结论或方法正确的是
| A.NH4+检验中可使用的试剂是NaOH溶液和浓盐酸 |
| B.NO2中混有的少量NO可用过量氧气除去 |
| C.某溶液中加入BaCl2溶液产生白色沉淀,加入稀HNO3后白色沉淀不溶,说明该溶液中至少含有Ag+或SO42-中的一种 |
| D.除去NH3中的少量H2O,可将混合气体通过干燥的CaCl2固体 |
同一主族元素形成的同一类型的化合物,在结构和性质方面往往是相似的。下列关于PH4I性质的叙述中,正确的是
| A.是一种共价化合物 | B.可与强碱发生反应 |
| C.加热时能升华 | D.高温时能分解,生成无色气体 |
38.4 mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4 mL(标准状况),反应消耗的HNO3的物质的量可能是
| A.1.0×10-3 mol | B.1.6×10-3 mol |
| C.2.2×10-3 mol | D.2.4×10-3 mol |
在2 L的密闭容器中发生反应:2SO2 + O2 2SO3,如果2 min内SO2的量由12 mol下降为4 mol,则下列说法正确的是
2SO3,如果2 min内SO2的量由12 mol下降为4 mol,则下列说法正确的是
| A.用SO2的浓度变化表示的反应速率为4 mol/(L·min) |
| B.用O2的浓度变化表示的反应速率为2 mol/(L·min) |
| C.增大压强,正反应速率增大,逆反应速率减小 |
| D.升高温度,正反应速率和逆反应速率都增大 |
对于反应2 SO2 + O2 2SO3 ,下列变化可以增大活化分子百分率使反应速率加快的是
2SO3 ,下列变化可以增大活化分子百分率使反应速率加快的是
① 加压 ② 升温 ③ 充入N2 ④ 使用催化剂
| A.①② | B.②③ | C.②④ | D.①②③④ |
一定温度下,在容积恒定的密闭容器中,发生如下反应: A(s) + 2B(g) 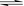 C(g) + D(g)当下列物理量不发生变化时,能表明该反应已达到平衡状态的是
C(g) + D(g)当下列物理量不发生变化时,能表明该反应已达到平衡状态的是
①容器内气体的压强 ②混合气体的密度
③B物质的物质的量浓度 ④混合气体的总的物质的量
| A.①④ | B.②③ | C.②③④ | D.只有③ |
在密闭容器中,反应xA(g)+yB(g) zC(g),达到平衡后测得A气体的浓度为0.5mol•L—1。保持温度不变,将密闭容器的容积增加一倍,当达到新的平衡时,测得A的浓度为0.3mol•L—1,则下列叙述中正确的是
zC(g),达到平衡后测得A气体的浓度为0.5mol•L—1。保持温度不变,将密闭容器的容积增加一倍,当达到新的平衡时,测得A的浓度为0.3mol•L—1,则下列叙述中正确的是
| A.平衡向正反应方向移动 | B.x+y>z |
| C.物质C的体积分数增大 | D.物质B的转化率增大 |
下列各组物质的颜色变化,可用勒夏特列原理解释的是
| A.新制的氯水在光照条件下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.KI溶液加氯水振荡后颜色变深 |
| D.加入催化剂有利于氨氧化的反应 |
对达到平衡状态的可逆反应:X+Y  W+Z,在t'时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是
W+Z,在t'时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是
| A.X、Y、W为气体,Z不是气体 |
| B.X、Y为气体,W、Z中有一种是气体 |
| C.W、Z为气体,X、Y中有一种是气体 |
| D.W、Z中有一种为气体,X、Y都不是气体 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 
| A.点a的逆反应速率比点b的大 |
| B.点c处反应达到平衡 |
| C.点d (t1时刻)和点e (t2时刻)处n(N2)不一样 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大 |
一定温度下,反应2 SO2 + O2 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)="0.8mol," n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)="0.8mol," n(SO3)=1.4mol,此时SO2的物质的量应是
| A.0.4mol | B.0.6mol | C.0.8mol | D.1.2mol |
下列操作能使H2O的电离平衡向逆方向移动,且溶液呈碱性的是
| A.向水中加NaHCO3 | B.向水中加NaHSO4 |
| C.向水中加FeCl3 | D.向水中加CaO |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3溶液 ⑥KCl溶液
| A.②④⑥ | B.①② | C.②③⑤ | D.②④⑤⑥ |
25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是
| A.1×10-7mol·L-1 | B.1×10-12mol·L-1 |
| C.1×10-2mol·L-1 | D.1×10-14mol·L-1 |
下列说法正确的是
| A.室温下,pH = 9的碱性溶液中,可能存在CH3COOH分子 |
| B.pH = 3的盐酸和pH = 5的硫酸等体积混合,pH = 4 |
| C.中性溶液中必然有c(H+) = c(OH-) = 1×10-7 mol/L |
| D.在0.1 mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
稀释0.1 mol/L的醋酸溶液,其中随水的增加而增大的有
⑴H+的物质的量 ⑵ c(H+) ⑶ c(OH—) ⑷ c(H+)/c(HAc) ⑸ c(HAc)/c(Ac—)
| A.⑴⑶⑷ | B.⑴⑶⑸ | C.⑵⑷ | D.⑶⑷ |
常温下,将pH = 5的硫酸溶液稀释到原来的500倍,则稀释后溶液中c(SO42-)与c(H+)之比大约为
| A.1∶1 | B.1∶10 | C.1∶2 | D.10∶1 |
室温下,某溶液中由水电离出来的c(H+)为1×10-12 mol/L,则该溶液中一定不可能大量存在的离子组是
| A.Cu2+、SO42-、Cl-、Na+ | B.Ca2+、Cl-、HCO3-、K+ |
| C.NH4+、NO3-、SO42-、Mg2+ | D.Cl-、SO42-、K+、Na+ |
对于相同物质的量浓度、相同体积的盐酸和醋酸,下列几种说法正确的是
| A.它们起始时溶液中的c(H+)相同 |
| B.各用水稀释一倍后,pH比较:盐酸>醋酸 |
| C.分别和同浓度的氢氧化钠溶液反应至pH=7,所用氢氧化钠溶液的体积不同 |
| D.各与足量的锌粒充分反应,产生H2的量不同 |
常温下,0.1 mol/L某一元酸(HA)溶液中 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.HA为强酸
B.溶液中c(H+)+c(A—)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体,溶液的c(OH—)增大
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A—)>c(Na+)>c(OH—)>c(H+)
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
| A.生成了一种强酸弱碱盐 |
| B.弱酸溶液和强碱溶液反应 |
| C.一元强酸溶液和强碱溶液反应 |
| D.二元强酸溶液和强碱溶液反应 |
用已知浓度的酸滴定未知浓度的碱时,会导致待测碱液浓度偏低的操作是
| A.碱式滴定管用蒸馏水洗后,未用待测液润洗 |
| B.酸式滴定管用蒸馏水洗后,未用标准液润洗 |
| C.滴定前,锥形瓶用蒸馏水洗后未烘干 |
| D.滴定前酸式滴定管尖嘴部分未充满溶液 |
如图,图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1 mL。如果刻度A和D都是4,则两处液面的读数是
A.Ⅰ中是3.2 mL,Ⅱ中是5.40 mL
B.Ⅰ中是4.8 mL,Ⅱ中是3.40 mL
C.Ⅰ中是3.2 mL,Ⅱ中是4.60 mL
D.Ⅰ中是4.8 mL,Ⅱ中是4.60 mL
(填化学式)在空气中:将氯化铁溶液蒸干并灼烧得到的固体物质_______________;碳酸氢钠溶液蒸干并灼烧得到的固体物质_____________;硫酸铝溶液蒸干得到的固体物质___________________;亚硫酸钠溶液蒸干得到的固体物质 __________ 。
水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
恒温、恒压下,在一个可变容积的容器中发生如下发应:
2 A(g)+ B(g) 2 C(g)
2 C(g)
(1)若开始时放入2 mol A和1 mol B,到达平衡后,生成a mol C,这时A的物质的
量为 mol。
(2)若开始时放入6 mol A和3 mol B,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x mol A,2 mol B和2 mol C,到达平衡后,A和C的物质的量分别是y mol和3 a mol,则x= mol。
(4)若在(3)的平衡混合物中再加入1 mol C,待再次到达平衡后,C的物质的量分数是 。
NaHCO3在水溶液中,HCO3-的电离程度小于HCO3-的水解程度。回答下列有关问题:
⑴H2CO3的电离方程式为 ;
⑵NaHCO3溶液显碱性,原因是(用离子方程式表示)
;
⑶在该溶液中,c(Na+)、c(H+)、c(HCO3-)、c(OH-)的大小关系为
;
⑷根据电荷守恒原理,该溶液中离子浓度关系有:
c(Na+)+c(H+)= ;
⑸根据物料守恒原理,该溶液中离子浓度关系有:
c(Na+)= 。
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。

①X的化学式为__________,属于________(填“极性”或“非极性”)分子。 ②图甲中条件选定的主要原因是(选填字母序号,下同)________。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应:
___________________________________________________________________。
②氨水中水电离出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③将氨水和盐酸混合后, 某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
Ⅱ、若上述关系中C是正确的,则溶液中溶质的化学式是 。
Ⅲ、若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成X和Y两种物质。X为铵盐,Y在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol X。
①写出氨气和氟气反应的化学方程式: ___________________________________。
②在标准状况下,每生成1 mol Y,转移电子的物质的量为___________mol。
(4)已知液态NH3与H2O相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则液态NH3的电离方程式为:
某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将 氧化成
氧化成 ,而稀硝酸不能氧化
,而稀硝酸不能氧化 。由此 得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此 得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与 反应,能与
反应,能与 反应
反应
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
、 、
(2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后鼓入过量CO2的目的是
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是 ,发生反应的化学方程式是
(5)该小组得出的结论依据的试验现象是
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法哪种正确 这些方案中可行的是 (选填序号字母)
这些方案中可行的是 (选填序号字母)
a. 加热该绿色溶液,观察颜色变化
b. 加水稀释绿色溶液,观察颜色变化
c. 向该绿色溶液中通入氮气,观察颜色变化
d. 向硝酸铜溶液中加入硝酸铜固体至饱和;同时向硝酸铜溶液中通入浓硝酸与铜反应
产生的气体,对比观察颜色变化
 粤公网安备 44130202000953号
粤公网安备 44130202000953号