(10分) 容积固定的密闭容器中,发生可逆反应:M(g)+N(g)  2P(g)+Q(g) ΔH>0,
2P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N 的浓度是 ,P 的体积分数为_________。
(2)若反应温度升高,M的转化率____________ (填“增大”“减小”或“不变”,下同),平均相对分子质量____________,混合气体密度____________。
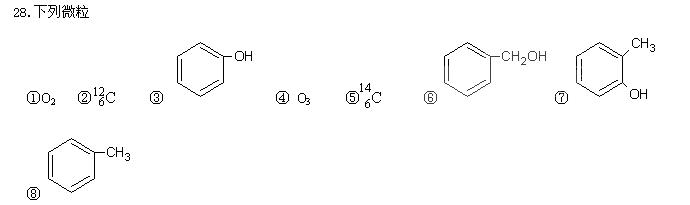 (1)属于同位素的是(填编号,下同)
(1)属于同位素的是(填编号,下同) 、AlCl3、CuCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体
、AlCl3、CuCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体 体积数据已换算成标准状况下的体积):
体积数据已换算成标准状况下的体积):
 算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)。
算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)。 的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物。它们在一定条件下可以发生如图所示的转化关系(均不是在溶液中进行的反应)以下每空中填入一种即可)。
的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物。它们在一定条件下可以发生如图所示的转化关系(均不是在溶液中进行的反应)以下每空中填入一种即可)。
 为
为 固体时,X与A反应的化学方程式为
固体时,X与A反应的化学方程式为 冷水反应,在标准状况下生成11.2LH2
冷水反应,在标准状况下生成11.2LH2 __;(用离子符
__;(用离子符 号和“>”、“=”或“<”表示)
号和“>”、“=”或“<”表示) 写化学式,下同),既含离子键又含共价键的是______________。
写化学式,下同),既含离子键又含共价键的是______________。 粤公网安备 44130202000953号
粤公网安备 44130202000953号