河南省长葛三高高二上学期第一次考试化学试题
下列叙述中正确的是()
| A.化反应一定有物质变化,不一定有能量变化 |
| B.化合反应一定是放热反应 |
| C.放热反应不需要加热就一定能发生 |
| D.吸热反应不加热也可能发生 |
一定条件下,在体积为VL的密闭容器中发生反应:
 pC,ts末,A减少了1mol, B减少了1.5mol,C增加了0.5mol,则下列各关系式正确的是( )
pC,ts末,A减少了1mol, B减少了1.5mol,C增加了0.5mol,则下列各关系式正确的是( )
| A.m="2P" | B. |
C. |
D.3n=P |
将等物质的量的A和B混合于2L的密闭容器中,发生如下反应: ,经过5
,经过5 后测得D的浓度为
后测得D的浓度为 ,C的反应速率为
,C的反应速率为 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
A.5 末,A的浓度为 末,A的浓度为 |
B.0-5 时,B的平均反应速率为 时,B的平均反应速率为 |
| C.B的起始物质的量为1.5mol |
| D.=2 |
一定条件下,在N2+3H2 2NH3的化平衡体系中,N2、H2、NH3的浓度分别为
2NH3的化平衡体系中,N2、H2、NH3的浓度分别为
 ,若起始时NH3有最大浓度,则起始时N2的浓度为( )
,若起始时NH3有最大浓度,则起始时N2的浓度为( )
A.0  |
B.3.2 |
C. |
D.无法确定 |
一定条件下某容器中发生反应:

 ,下列不能判断反应达到平衡的标志的是( )
,下列不能判断反应达到平衡的标志的是( )
| A.气体密度不变 | B. |
| C.压强不变 | D.反应速率不变 |
已达到平衡的下列可逆反应中,增大压强(缩小体积),体系的颜色不变深的是( )
A.2   |
B.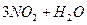   |
C.2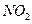  2NO+O2 2NO+O2 |
D.  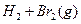 |
一定条件下,等物质的量的N2和H2反应达平衡时,NH3的体积分数为40%,则下列叙述不正确的是( )
| A.N2的转化率为28.57% | B.H2的转化率为85.7% |
| C.N2的体积分数为20% | D.H2的体积分数为10% |
一定温度下,有可逆反应,

 ,
,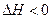 ,现将
,现将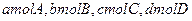 充入体积为V的某容器中,达平衡时各物质的浓度恰好相等,则升高一定温度后,反应达到新平衡时的化平衡常数可能为( )
充入体积为V的某容器中,达平衡时各物质的浓度恰好相等,则升高一定温度后,反应达到新平衡时的化平衡常数可能为( )
| A.1 | B.1.01 | C.0.90 | D.无法确定 |
已知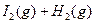

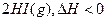 。有相同容积的定容密闭容器甲和乙,甲中加入 H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中的HI的平衡浓度,应采取的措施是( )
。有相同容积的定容密闭容器甲和乙,甲中加入 H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中的HI的平衡浓度,应采取的措施是( )
| A.甲、乙提高相同温度 | B.甲中加入0.1mol He,乙不变 |
| C.甲降低温度,乙不变 | D.甲增加0.1mol H2,乙增加 0.1mol I2 |
 是制备硫酸的重要反应。下列叙述正确的( )
是制备硫酸的重要反应。下列叙述正确的( )
A.催化剂 不改变该反应的逆反应速率 不改变该反应的逆反应速率 |
| B.增大反应体系的压强,反应速率一定增大 |
C.在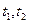 时刻, 时刻, 的分别是 的分别是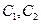 ,则时间间隔 ,则时间间隔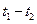 内, 内, 生成的平均速率为 生成的平均速率为 |
| D.该反应是放热反应,降低温度将缩短反应达到平衡时间 |
下列关于强、弱电解质的叙述中,正确的是( )
| A.强电解质都是离子化合物,弱电解质都是共价化合物 |
| B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 |
| C.强电解质熔化时都完全电离,弱电解质在水溶液中部分电离 |
| D.强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱 |
向体积相同,pH为1的 溶液中,分别加入足量的金属镁,下列说法中不正确的是( )
溶液中,分别加入足量的金属镁,下列说法中不正确的是( )
A. 产生的H2最多 产生的H2最多 |
B.HNO3产生的H2最少 |
C. 和HCl产生的H2一样多 和HCl产生的H2一样多 |
D. 产生的H2比HCl产生的H2多 产生的H2比HCl产生的H2多 |
下列事实不能证明 是弱酸的是( )
是弱酸的是( )
A. 溶液能使石蕊溶液变红 溶液能使石蕊溶液变红 |
B.0.1 mol/L的 ,H+浓度为0.01mol/L ,H+浓度为0.01mol/L |
C.等物质的量浓度的 导电能力比盐酸弱 导电能力比盐酸弱 |
D.0.01mol/L的 溶液中有两种分子存在 溶液中有两种分子存在 |
用蒸馏水逐渐稀释 的醋酸,若维持温度不变,则在稀释过程中逐渐增大的是( )
的醋酸,若维持温度不变,则在稀释过程中逐渐增大的是( )
A. 的物质的量浓度 的物质的量浓度 |
B. 的物质的量浓度 的物质的量浓度 |
| C.H+的物质的量浓度 | D. 和H+的物质的量 和H+的物质的量 |
(每空3分,共9分)在一定条件下,反应 达到平衡。
达到平衡。
(1)若A、B、C都是气体,在增压后平衡向逆反应方向移动,则,y,之间的关系是 。
(2)若C是气体,且+y=,在增大压强时,如果平衡发生移动,则A的转化率将 (填“增大”、“减小”或“不变”)
(3)若A为固体,B、C为气体,且y>,则增大压强时混和气体的平均相对分子质量将 (填“增大”“减小”或“不变”)
(每小题3分,共9分)恒温恒压下,在一个容积可变的密闭容器中发生如下反应: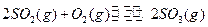
(1)若开始时通入 ,达平衡时生成
,达平衡时生成 的转化率为 。
的转化率为 。
(2)若开始时通入 ,达平衡时SO2的物质的量为 mol。
,达平衡时SO2的物质的量为 mol。
(3)若在(2)的平衡混合物中再通入bmol SO3,则达到平衡时SO3的体积分数是 。
废旧印刷电路板的回收利用可实现资再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: ====
====

 ====
====

 ="==="
="===" 

在 溶液中
溶液中 与
与 反应生成
反应生成 和
和 的热化方程式为 。
的热化方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅ 和3.0
和3.0 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜平均溶解速率 (  )[:.....] )[:.....] |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 和
和 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是 。
的离子方程式是 。
将一定量的SO和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2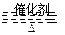 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
(每空2分)反应A()+B()  C() +D()过程中的能量变化如图所示,回答下列问题。
C() +D()过程中的能量变化如图所示,回答下列问题。
(1)该反应是____________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),
原因是____________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________:
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。









 [:]
[:] 粤公网安备 44130202000953号
粤公网安备 44130202000953号