卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2+ Br-+ 3H2O
② 2BrO3- + I2= 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2+ 3H2O
④ 2IO3- + 10Br-+ 12H+ = I2+ 5Br2+ 6H2O
实验如下:
| 步骤 |
现象 |
| ⅰ. 向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 |
随着KBrO3溶液的滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ. 继续向上述溶液中滴入KBrO3溶液 |
溶液的蓝色逐渐褪去 |
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol e-,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
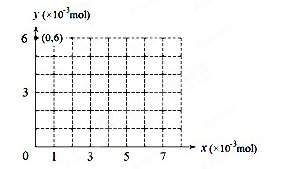
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
由铜片、锌片和200 mL 稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36 L(标准状况)气体时,H2SO4恰好完全消耗。求:
(1)反应中消耗的锌的质量是________
(2)原稀H2SO4的物质的量浓度是________
碳、硅、锗、锡、铅的单质及化合物是重要的工业材料。
(1)金刚石和石墨是碳的两种同素异形体,相同条件下石墨更稳定,则石墨转化为金刚石的反应是______(填“放热”或“吸热”)反应。
(2)SiO2在通信领域的一种重要用途是______。SiO2晶体中的基本结构单元是_____。
(3)SnCl2有较强的还原性,写出SnCl2与FeCl3溶液反应的离子方程式 。
(4)铅丹(Pb3O4)可作为防锈用涂料,呈红褐色。可采用PbS在空气中连续氧化的方法制备:PbS →PbO→Pb3O4,写出第一步氧化的化学方程式 。铅丹曾用于铁制品防锈,请说明它的主要危害 。1 mol铅丹与足量浓盐酸反应时,转移的电子数目为2 NA,写出该反应的化学方程式 。
(5)金属锗、锡在空气中不反应,铅在空气中表面生成一层氧化铅,可能的原因是: 。
现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸的浓度为4mol/L,稀硝酸的浓度为2 mol/L。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到的气体成分为 、 ;体积分别是 L、 L。(假设HNO3只被还原为NO)
向由Cu、Cu2O和CuO组成的混合物中,加入10 mL 6 mol·L-1的稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 224 mL。请回答以下问题:
(1)写出Cu2O与稀硝酸反应的离子方程式 。
(2)产物中硝酸铜的物质的量为 。
(3)若原混合物中有0.01molCu,则其中Cu2O的物质的量为 ,CuO的物质的量为 。
(12分)碱式次氯酸镁[Mga(ClO)b(OH)c·xH2O]是一种有开发价值的微溶于水的无机抗菌剂。为确定碱式次氯酸镁的组成,进行如下实验:
①准确称取1.685 g碱式次氯酸镁试样于250 mL锥形瓶中,加入过量的KI溶液,用足量乙酸酸化,用0.800 0 mol·L-1的Na2S2O3标准溶液滴定至终点(离子方程式为2S2O32-+I2===2I-+S4O ),消耗25.00 mL。
),消耗25.00 mL。
②另取1.685 g碱式次氯酸镁试样,用足量乙酸酸化,再用足量3%H2O2溶液处理至不再产生气泡(H2O2被ClO-氧化为O2),稀释至1 000 mL。移取25.00 mL溶液至锥形瓶中,在一定条件下用0.020 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Mg2+(离子方程式为Mg2++H2Y2-===MgY2-+2H+),消耗25.00 mL。
(1)步骤①需要用到的指示剂是________。
(2)步骤②若滴定管在使用前未用EDTA标准溶液润洗,测得的Mg2+物质的量将________(填“偏高”“偏低”或“不变”)。
(3)通过计算确定碱式次氯酸镁的化学式(写出计算过程)。
研究NO2、SO2 等大气污染气体的处理具有重要意义。
(1)铜与浓硝酸反应生成NO2的化学反应方程式是 。
(2)NO2可用水吸收,该反应的化学反应方程式是 。
(3)工业上可将SO2通入浓的Fe2(SO4)3溶液中来治理污染得副产物绿矾和硫酸,写出该反应的离子方程式 。
(4)利用反应6NO2 + 8NH3 7N2 + 12H2O也可处理NO2。当反应转移0.6mol电子时,则消耗的NH3在标准状况下的体积是 L。
7N2 + 12H2O也可处理NO2。当反应转移0.6mol电子时,则消耗的NH3在标准状况下的体积是 L。
(5)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1=" -" 196.6 kJ·mol-1
2SO3(g) ΔH1=" -" 196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH2=" -" 113.0 kJ·mol-1
2NO2(g) ΔH2=" -" 113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的
SO3(g)+NO(g)的
ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以物质的量之比1∶2置于恒容密闭容器中发生上述反应。
①下列能说明反应达到平衡状态的是( )。
| A.体系压强保持不变 | B.SO3和NO的体积比保持不变 |
| C.混合气体颜色保持不变 | D.每消耗1 mol SO3的同时消耗1 mol NO2 |
②测得上述反应平衡时NO2与SO2物质的量之比为1∶11,该反应的平衡常数K = (保留1位小数)。
(10分,三氧化二砷,俗称砒霜,分子式As2O3是最具商业价值的砷化合物及主要的砷化学开始物料。它也是最古老的毒物之一,无臭无味,外观为白色箱状粉末,故称砒霜。
(1)完成并配平下列化学方程式:
(2)As2O3在上述反应中显示出来的性质是_____________.
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(3)若生成0.2molAsH3 ,则转移电子的物质的是为___________mol.
(4)砷化氢AsH3是一种很强的还原剂,在室温下它能在空气中自燃,其氧化产物是砒霸,写出该反应的化学方程式_________。
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1)硝酸在该反应中表现出的性质是_____________________。
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是________mol。
(3)0.3molCu被另一浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积在标准状况下为8.96 L,则被还原的硝酸的物质的量是_______mol,参加反应的硝酸的物质的量是______mol,产生的混合气体中NO和NO2体积比为_______。
【改编】(17分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g)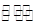 2NH3(g)
2NH3(g)  H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
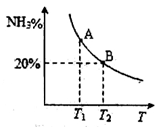
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2(填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,氮气的平衡转化率 (填“增大”、“减小”或“不变”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(NH3)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则V正 V逆(填“>”或“<”或“=”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1)△H,在一定压强下测得如下数据:
H2O(1)+CO(NH2)2(1)△H,在一定压强下测得如下数据:
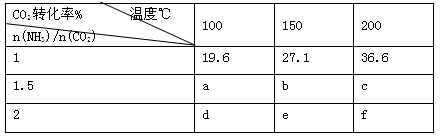
①该反应破坏旧化学键吸收的能量 形成新化学键放出的能量,表中数据a d,b f(均选填“>”、“=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
(12分)次硫酸氢钠甲醛(xNaHSO2·yHCHO·zH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:① 准确称取1.540 0 g样品,完全溶于水配成100 mL溶液;② 取25.00 mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10 mol·L-1;③ 另取25.00 mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.582 5 g。次硫酸氢钠甲醛和碘反应的方程式如下:
xNaHSO2·yHCHO·zH2O+I2―→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.582 5 g白色固体时,需要消耗碘的质量为________。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式________________________________。
(3)通过计算确定次硫酸氢钠甲醛的组成(写出计算过程)。
有七种物质:① 铝,② A12O3,③ 稀硝酸,④ NaHCO3,⑤ Ba(OH)2固体,⑥ 氨水,⑦ A12(SO4)3,根据下列要求回答问题:
(1)属于电解质的是 (填序号)。
(2)既能与强酸反应,又能与强碱反应的是 (填序号)。
(3)34.2 g ⑦ 溶于水配成500 mL溶液,溶液中SO42-的物质的量浓度为 。
(4)①与③发生反应的化学方程式为A1+4HNO3=A1(NO3)3+NO↑+2H2O,该反应中还原剂与氧化剂的物质的量之比是 。
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气: N2(g)+3H2(g)⇌2NH3(g) △H<0,一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,容器内的压强是原来的 ,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。
,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸:
①NH3被氧气催化氧化生成NO的反应的化学方程式是___________________________________;
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)⇌2NO2(g)△H>0 该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)_______________;
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2(g)⇌N2O4(g) △H<0,恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1、a2,已知T1<T2,则a1_______a2
| A.大于 | B.小于 | C.等于 | D.以上都有可能 |
(3)硝酸厂常用如下2种方法处理尾气:
①催化还原法:催化剂存在时用H2将NO2还原为N2;
已知:2H2(g)+O2(g)=2H2O(g) △H=﹣483.5kJ/mol 、N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是_________________________;
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2,若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是__________________________________。
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为 。
若以该电池为电源,用石墨做电极电解100 mL含有如下离子的溶液。
| 离子 |
Cu2+ |
H+ |
Cl- |
 |
| c/mol·L-1 |
1 |
4 |
4 |
1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气标况下的体积为 L。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
①写出阳极电极反应式 ;
②除去甲醇的离子反应为 ,该过程中被氧化的元素是 ,当产生标准状况下2.24 L CO2时,共转移电子 mol。
已知钙的金属活泼性介于钾和钠之间,其化学性质与钠相似。钙及其化合物的有关反应如下:
①Ca+2H2O=Ca(OH)2+H2↑ ②CaO+H2O=Ca(OH)2 ③CaO+CO2=CaCO3
④CaO2+H2O= (未配平) ⑤2CaO2+2CO2=2CaCO3+O2
结合所学知识完成下列问题:
(1)写出上述④的化学方程式: ;
(2)用单线桥标出反应①的电子转移方向和数目:Ca+2H2O Ca(OH)2+H2↑
Ca(OH)2+H2↑
(3)写出以钙为原料制取过氧化钙(CaO2)的化学方程式: ;
(4)在CaO2的水溶液中,滴入酚酞溶液,预期的实验现象可能是 。