红热的铁与水蒸气可发生反应:3Fe+ ,其中铁被__________(填“氧化”或“还原”),H2O作__________(填“氧化”或“还原”)剂。在该反应中,若消耗了3 mol Fe,转移电子的物质的量是__________。
,其中铁被__________(填“氧化”或“还原”),H2O作__________(填“氧化”或“还原”)剂。在该反应中,若消耗了3 mol Fe,转移电子的物质的量是__________。
次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(1)H3PO2及NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①在H3PO2中,磷元素的化合价为 ;在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为: (填化学式)。
②NaH2PO2是 (填“正盐”还是“酸式盐”),其溶液中离子浓度由大到小的顺序应为
③0.2 mol·L-1 H3PO2溶液与0.2mol·L-1NaOH溶液等体积混合后所得溶液中:
c(H2PO2-)+c(OH-)-c(H+)= mol·L-1。(溶液体积变化忽略不计)
(2)次磷酸(H3PO2)可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):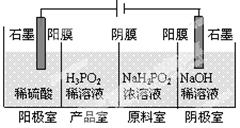
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因 (用离子方程式表示)
(10分)化学电池是将化学能转变成电能的装置,包括一次电池、二次电池和燃料电池等几大类。燃料电池是目前正在探索的一种新型电池,已经使用的氢氧燃料电池的基本反应是:
X极:O2+2H2O+4e-=4OH- Y极:2H2+4OH—=4H2O+4e- 请回答下列问题 :
(1)X是 极;Y极发生 反应(填“氧化”或“还原”)
(2)该电池总反应方程式为
(3)若反应后的得到5.4 g液态水,此时氢氧燃料电池转移的电子数为 。
(4)实验室用铅蓄电池作电源电解饱和食盐水,若制得Cl2 0.30 mol,电池内至少消耗H2SO4 mol。
(14分)结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的正确装置是 (填字母)。
将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有 。
(2)氯气可用于生产漂白粉。由于盐酸浓度不同,漂白粉与盐酸混合发生反应的反应类型不同。
漂白粉与稀盐酸发生复分解反应,离子方程式为 。
漂白粉与浓盐酸发生氧化还原反应,离子方程式为 。
(3)某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
a.Cl2+2I-=2Cl-+I2
b.Cl2+2Fe2+=2Cl-+2Fe3+
c.5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示。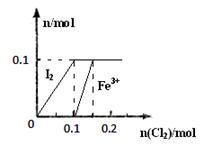
请回答下列问题:
①当n(Cl2)=0.12mol时,不考虑水的电离及金属离子的水解,分析溶液中所含金属阳离子及其
物质的量 (写出计算过程,否则不得分)。
②当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为 L(写出计算过程,否则不得分)。
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题。
(1)工业上可用Cu2S+O2 2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
2Cu+SO2。反应制取粗铜,当消耗32 g Cu2S时,转移电子的物质的量为____________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃-60℃,加入H2O2,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:________________.CuSO4溶液中加入一定量的Na2SO3溶液和NaCI溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________。
(3)电子工业常用30%的FeCl3溶液腐蚀附在绝缘板上的铜箔制造印刷电路板,取其腐蚀后的废液,加入一定量的铁粉后,若无固体剩余,则反应后的溶液中肯定有的离子是________________;若有红色固体,则反应后的溶液中肯定没有的离子是________,检验该离子的试剂为________。
(4)铁氰化钾 K3[Fe(CN)5]和亚铁氰化钾K4[Fe(CN)6] 的混合溶液可用于太阳能电池的电解液,该太阳能电池的工作原理示意图如图所示,其中催化剂a为________极,电极反应式为________;
常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下: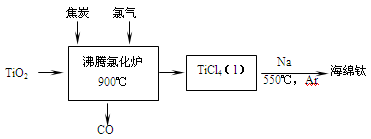
(1)TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为 。
③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3 + 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为 mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K= 。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是 (填序号)。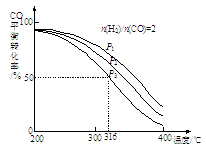
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。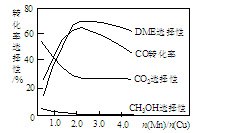
催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(15分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下: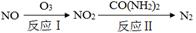
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。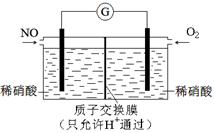
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。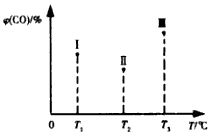
(14分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
a、写出由磷酸钙矿制取白磷总的反应方程式_____________________________。
b、上述反应中SiO2起何作用?______________________________________。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间(已知磷酸的各级电离常数为:K1= 7.1×10−3 K2 = 6.3×10−8 K3 =4.2×10−13 lg7.1≈0.9 lg6.3≈0.8 lg≈0.6) 。Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 |
Na+ |
K+ |
Ca2+ |
Mg2+ |
Cl- |
SO42- |
HCO3- |
| 含量/mg∙L-1 |
9360 |
83 |
160 |
1100 |
16000 |
1200 |
118 |
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。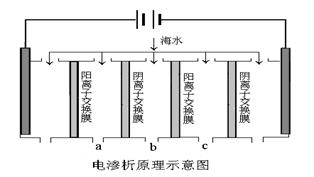
① 开始时阳极的电极反应式为 。
② 电解一段时间, 极(填“阴”或“阳”)会产生水垢,其成份为 (填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示: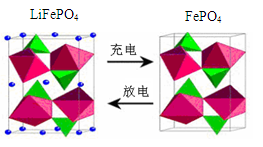
该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示 (填粒子符号),充电时该电极反应式为 。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为 (空气中氧气的体积分数按20%计)。
(1)地壳中含量最高的金属是 ,NaHCO3俗称 ,制造计算机芯片的半导体材料是 ,水晶项链的主要成分是 。
(2)在反应3Cu+8 HNO3(稀)="=" 3Cu(NO3)2+2NO↑+4H2O中,失去电子的是_____(填元素符号),被还原的是_____(填元素符号)。当产生标况下4.48 L气体时消耗单质铜_____g,此时转移了_____ mol电子。
将1.92 g铜置入一定量的浓硝酸中,并微热,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜反应完毕时(铜片完全消失),共收集到标况下气体1.12 L(设不含N2O4),求:
(1)收集到的气体中主要有含有 ;
(2)上述过程中,有关反应的化学方程式为 ; ;
(3)反应中被还原的HNO3的物质的量是 ;
(4)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是多少摩尔?(计算过程)
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,其正极反应为____________________________,
负极反应为__________________________________________。
(2)若电解质溶液为硫酸,其正极反应为______________________,
负极反应为___ ______________。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。计算:
①电解池阳极生成氯气的物质的量是 mol。
②氢氧燃料电池中转移的电子数目是 个
消耗H2的质量是 g。(写出计算过程)(保留2位小数)
(10分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
3FeS2+8O2 6SO2+Fe3O4
6SO2+Fe3O4
该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
(2)氯化铁溶液显酸性,原因是___________________(用适当的文字和离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:____________________________________。
(3)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为: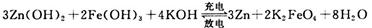
放电时电池的负极反应式为____________________;充电时电解液的pH________(填“增大”“减小”或“不变”之一)。
H2O2是重要的化学试剂,在实验室和生产实际中应用广泛。
(1)H2O2不稳定,其生产过程要严格避免混入Fe2+和Fe3+,否则会发生如下两个反应,加快其分解,且Fe2+和Fe3+各自的量保持不变。
①2Fe2+ + H2O2 + 2H+=2Fe3+ + 2H2O
② (填离子方程式)。
(2)H2O2的水溶液显弱酸性,写出一个用盐酸制取H2O2的化学方程式__________________。
(3)H2O2在使用中通常不会带来污染。
①工业上利用Cl2 + H2O2 =" 2HCl" + O2除氯,在此反应中被氧化的物质是______________。
②消除某废液中的氰化物(含CN-),完成下列反应:
CN- + H2O2 + H2O=____________ + NH3↑
(4)实验室常用酸性KMnO4溶液测定H2O2的浓度。
取10.00 mL H2O2溶液样品(密度近似为1g/mL)于锥形瓶中,加水到50.00 mL,当滴入0.10 mol/L KMnO4 溶液40.00 mL后,恰好完全反应。则原样品中H2O2的质量分数是_______________。
关于金属的冶炼和应用,有以下一些问题,请按要求回答问题。
(1)工业制备铝一般是通过铝土矿制得纯净的Al2O3,然后电解Al2O3/Na3AlF6得到铝。也可用电解NaCl—KCl—AlCl3共熔体方法制铝,且比电解Al2O3/Na3AlF6制铝节省电能约30%,但现在仍用前一种方法制铝,其原因可能是( )(填序号)
A.AlCl3是共价化合物,其熔融体不导电
B.电解AlCl3生成的Cl2会污染大气
C.自然界不存在富含AlCl3的矿石,故此方法所用流程较繁琐
D.生产无水AlCl3较困难,此方法总成本比另一种方法高
(2)把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )(填序号)
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
(3)航母螺旋桨主要用铜合金制造。为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合下图的信息推断该合金中除铜外一定含有 (填化学式)。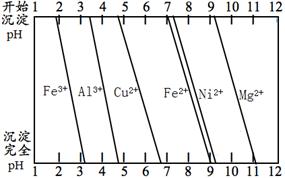
(4)1.92 g铜和一定量的浓硝酸反应,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当Cu全部反应时,共收集到标准状况下气体1.12 L(无N2O4),则反应中消耗HNO3的物质的量是 。