湖北省宜昌市省示范高中高一期末化学试卷
为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是
| A.碳水化合物 | B.醇类 | C.氢气 | D.碳氢化合物 |
放射性同位素钬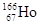 的原子核内的中子数与核外电子数之差是
的原子核内的中子数与核外电子数之差是
| A.32 | B.67 | C.99 | D.166 |
下列物质分类正确的是
| A.FeO、Fe2O3、Na2O2均为碱性氧化物 |
| B.稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C.烧碱、冰醋酸、四氯化碳均为电解质 |
| D.盐酸、水玻璃、氨水均为混合物 |
下列有关物质性质的应用正确的是
| A.氯化铝是一种电解质,可用于电解法制铝 |
| B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| C.生石灰能与水反应,可用来干燥氯气 |
| D.液氨汽化时要吸收大量的热,可用作制冷剂 |
有关基本营养物质说法正确的是
| A.淀粉和纤维素互为同分异构体 |
| B.油脂没有固定的熔沸点 |
| C.葡萄糖、果糖、蔗糖都能发生水解反应 |
| D.糖类、油脂、蛋白质都是高分子化合物 |
下列有关物质变化的说法不正确的是
| A.煤的液化和气化都是化学变化 |
| B.硝化反应和酯化反应都属于取代反应 |
| C.石油的分馏和裂化都是化学变化 |
| D.乙烯与溴和水的反应都属于加成反应 |
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| |
X |
Y |
Z |
| ① |
NaOH溶液 |
Al(OH)3 |
稀硫酸 |
| ② |
KOH溶液 |
SiO2 |
浓盐酸 |
| ③ |
O2 |
N2 |
H2 |
| ④ |
FeCl3溶液 |
Cu |
浓硝酸 |
A.①③ B.①④ C.②④ D.②③
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA |
| B.1.5 mol NO2与足量水反应,转移的电子数为1.5 NA |
| C.6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
| D.常温常压下,11.2 L Cl2含氯原子数为NA |
下列反应的离子方程式书写正确的是
| A.过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-=2Fe2++I2 |
| B.含等物质的量的MgCl2、Ba(OH)2、HNO3三种溶液混合:Mg2++2OH-=Mg(OH)2↓ |
| C.CaCO3溶于醋酸:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| D.向海带灰浸出液中加入硫酸、双氧水:2I-+H2O2=2OH-+I2 |
烃类分子中的碳原子与其它原子的结合方式是
| A.形成四对共用电子对 | B.通过非极性键 |
| C.通过两个共价键 | D.通过离子键和共价键 |
下列关于原子结构、元素性质的说法正确的是
| A.非金属元素组成的化合物中只含共价键 |
| B.ⅠA族金属元素是同周期中金属性最强的元素 |
| C.同种元素的原子均有相同的质子数和中子数 |
| D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列说法不正确的是
| A.X、Y、Z中最简单氢化物稳定性最弱的是Y |
| B.Z元素最高价氧化物对应水化物的酸性一定强于Y |
| C.X与Y元素形成的两种常见化合物分别溶于水后溶液pH<7 |
| D.Z元素单质在化学反应中只表现氧化性 |
下列物质中不能用来区分乙酸、乙醇、苯的是
| A.溴水 | B.碳酸钠溶液 |
| C.紫色石蕊试液 | D.金属钠 |
为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
| |
物质 |
试剂 |
分离方法 |
| ① |
硝酸钾(氯化钠) |
蒸馏水 |
降温结晶 |
| ② |
二氧化碳(氯化氢) |
饱和碳酸钠溶液 |
洗气 |
| ③ |
乙酸乙酯(乙酸) |
氢氧化钠溶液 |
分液 |
| ④ |
氯气(氯化氢) |
饱和氯化钠溶液 |
洗气 |
A.①③ B.①④ C.只有② D.③④
在溶液中能大量共存的微粒组是
| A.K+、CH3COOH、CO32-、NO3- | B.Fe3+、Na+、SCN-、Cl- |
| C.Ba2+、Na+、OH-、HCO3- | D.H+、K+、Fe3+、NO3- |
下图是铅蓄电池构造示意图,下列说法不正确的是
| A.铅蓄电池是二次电池,充电时电能转化为化学能 |
| B.电池工作时,电子由Pb板通过导线流向PbO2板 |
| C.电池工作时,负极反应为:Pb-2e-=Pb2+ |
| D.电池工作时,H+移向PbO2板 |
分析下表中有机物的排列规律,可写出横线上物质的分子式。则横线上能与金属钠反应放出氢气的有机物有(不含立体异构)
| 1 |
2 |
3 |
4 |
5 |
6 |
… |
| CH4O |
C2H6O |
C3H8O |
|
C5H12O |
C6H14O |
… |
A.3种 B.4种 C.5种 D.6种
香叶醇的结构简式如图。下列有关香叶醇的叙述正确的是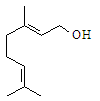
| A.香叶醇的分子式为C10H18O |
| B.不能使溴的四氯化碳溶液褪色 |
| C.不能使酸性高锰酸钾溶液褪色 |
| D.能发生加成反应不能发生取代反应 |
一定条件下,反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在密闭容器中进行, 反应速率最快的是
| A.υ(NH3)=0.0020 mol/(L·s) | B.υ(O2)=0.0026mol/(L·s) |
| C.υ(NO)=0.0020 mol/(L·s) | D.υ(H2O)=0.0028mol/(L·s) |
m g Fe、Fe3O4、Fe2O3的混合物用足量H2还原,固体质量减少4.8 g;若将等质量的混合物加入足量的稀硝酸中,产生2.24 L NO气体(标准状况下)。有关该混合物的下列说法不正确的是
| A.参加反应的H2和硝酸的物质的量之比为3:1 |
| B.混合物中氧原子的物质的量为0.3 mol |
| C.混合物中铁原子的物质的量为0.3 mol |
| D.参加反应的硝酸的物质的量为1 mol |
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z单质可制成半导体材料,W与X属于同一主族。完成下列有关问题:
(1)元素X的一种核素含10个中子,该核素可表示为________,X的一种氢化物常用来消毒,该氢化物的电子式为________。元素Z在周期表中的位置是________。
(2)元素X和W的简单氢化物中,沸点高的是________(填化学式),理由是________。
(3)请列举两个事实说明元素W的非金属性比Z强: 。
(4)元素X、Y、Z、W形成的二元化合物(指含两种不同元素的化合物)中,化学键的类型相同的一组化合物的化学式是 。
(5)四种元素的原子半径由大到小的顺序是________(填元素符号)。X、Y、W三种元素的原子形成的简单离子中,半径最小的是________(填离子符号)。
碳、硅、锗、锡、铅的单质及化合物是重要的工业材料。
(1)金刚石和石墨是碳的两种同素异形体,相同条件下石墨更稳定,则石墨转化为金刚石的反应是______(填“放热”或“吸热”)反应。
(2)SiO2在通信领域的一种重要用途是______。SiO2晶体中的基本结构单元是_____。
(3)SnCl2有较强的还原性,写出SnCl2与FeCl3溶液反应的离子方程式 。
(4)铅丹(Pb3O4)可作为防锈用涂料,呈红褐色。可采用PbS在空气中连续氧化的方法制备:PbS →PbO→Pb3O4,写出第一步氧化的化学方程式 。铅丹曾用于铁制品防锈,请说明它的主要危害 。1 mol铅丹与足量浓盐酸反应时,转移的电子数目为2 NA,写出该反应的化学方程式 。
(5)金属锗、锡在空气中不反应,铅在空气中表面生成一层氧化铅,可能的原因是: 。
海水水资源的利用和海水化学资源的开发利用具有非常广阔的前景。
(1)列举海水淡化的两种方法:________、 。
(2)采用“空气吹出法”从浓海水吹出Br2,用SO2吸收,则发生反应的离子方程式为 。还可以用纯碱吸收,主要反应是Br2+Na2CO3+H2O → NaBr+NaBrO3+NaHCO3,当吸收1 mol Br2时,转移电子的物质的量为________mol。
(3)按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。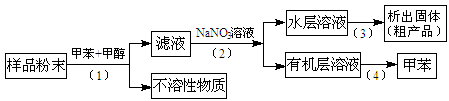
下列说法正确的是________。
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
①甲烷、②乙烷、③乙烯、④苯、⑤甲苯、⑥二甲苯、⑦乙醇、⑧乙酸、⑨葡萄糖,它们都是常见的重要化工原料。
(1)上述物质中,氢元素的质量分数最大的是________(填分子式),等质量的物质完全燃烧耗氧量相同的是________(填分子式)。
(2)上述物质中,能发生加成反应的烃类物质有:________(填序号)。
(3)甲烷和苯都可以发生取代反应,反应条件分别是________、________。
(4)聚氯乙烯,简称PVC,这种材料如果用于食品包装,它对人体的安全性有一定的影响,PVC由Cl—CH=CH2在一定条件下聚合而成,写出该反应的化学方程式: 。
(5)苯、甲苯、二甲苯是用途广泛的有机溶剂。二甲苯的结构有______种,其中一种被称为“PX”,它的一氯代物只有两种,则“PX”的结构简式是 。
(6)乙醇与乙酸发生酯化反应的化学方程式 。某同学在做乙醇的催化氧化时发现:当烧黑的铜丝不小心接触到酒精灯焰心时,局部瞬间呈现光亮的红色,请用必要的文字结合化学方程式予以解释 。
Ⅰ.1100℃时,体积为2L的恒容容器中发生如下反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
(1)下列能判断反应达到平衡状态的是________。
| A.容器内气体压强不再变化 |
| B.H2的体积分数不再变化 |
| C.1 mol H-H键断裂同时2 mol H-O键形成 |
| D.Na2S的质量不再变化 |
E.υ(正)=υ(逆)
F.容器内气体密度不再变化
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为: 。
Ⅱ.丙烷燃料电池,以KOH溶液为电解质溶液。
(3)通入丙烷的电极为_____(填“正极”或“负极”),正极的电极反应式为 。
(4)燃料电池的优点________。
(5)若开始时电解质溶液中含KOH的物质的量为0.25 mol,当溶液中K2CO3的物质的量为0.1 mol时,消耗标准状况下丙烷的体积为 mL(保留一位小数)。
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)铝粉和铁的氧化物(FeO·Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是 。
(2)NaOH溶液可以除去铝表面的氧化膜,在处理过程中常会产生H2,产生H2的离子方程式是 。
(3)工业上以铝土矿(Al2O3·H2O)为原料生产铝,主要包括下列过程:
i.将粉粹、筛选后的铝土矿溶解在NaOH溶液中;
ii.加入过量的试剂A使所得溶液中析出Al(OH)3固体;
iii.使Al(OH)3脱水生成Al2O3;
iv.电解熔融Al2O3生成Al。
铝土矿粉粹的目的是 ,试剂A的化学式是 ,电解熔融Al2O3时,加入冰晶石,其作用是 。
(4)明矾化学式为KAl(SO4)2·12H2O,向明矾溶液中加入Ba(OH)2溶液,当溶液中的SO42-恰好沉淀时,铝元素的存在形式是 。
(5)美国普度大学研究开发出一种利用铝镓(镓:Ga)合金制取氢气的新工艺(如下图所示)。
i.写出常温下铝镓合金产生氢气的化学方程式 。
ii.下列有关该工艺的说法正确的是 。
| A.该过程中,能量的转化形式只有两种 |
| B.铝镓合金可以循环使用 |
| C.铝镓合金的熔点比金属铝低 |
| D.该工艺可利用太阳能分解水 |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号