期中备考总动员高三化学模拟卷【山东】4
【原创】化学与生活、社会、材料、能源关系密切,下列说法不正确的是
| A.人们常用漂粉精和明矾进行水的处理,二者的作用和反应原理不同 |
| B.航天服材质是由碳化硅/陶瓷和碳纤维等复合而成,它是一种新型无机非金属材料 |
| C.用于制作航空母舰上拦阻索的钢材是一种复合材料 |
| D.煤、沼气和液化石油气分别属于化石能源、可再生能源和二次能源 |
短周期元素X、Y、Z、W的原子序数依次增大,其中Y、Z原子的核外电子数之和与X、W原子的核外电子数之和相等,Z单质可以用来冶炼其它熔点较高的金属,X和W间可形成一种能产生酸雨的化合物,则下列说法不正确的是
| A.原子半径从大到小顺序为:W>Z>Y>X |
| B.X与Y可形成既含离子键又含非极性共价键的化合物 |
| C.X、W分别形成简单的氢化物中,前者的沸点高 |
| D.X形成单核阴离子的核外电子数与Y、Z、W原子的核外内层电子数相同 |
【原创】下列说法正确的是
| A.NA为阿伏加德罗常数,则25g14C18O2所含中子数目为12 NA |
| B.标准状况下,体积为3.36L的SO3的质量为12g |
| C.在点燃条件下,5.6g铁分别与足量的氯气、氧气中完全燃烧,转移的电子数相等 |
| D.同温同压下,12C18O和14N2体积相等时具有的电子数相等 |
磷酸吡醛素是细胞重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯,其结构式如图。下列说法错误的是
| A.该酯分子式为C8H9O6NP |
| B.该酯能使石蕊试液变红 |
| C.该酯能与金属钠反应 |
| D.该酯能与乙醇发生酯化反应 |
【原创】下列有关离子反应的说法或表达正确的是
| A.次氯酸钠具有强氧化性,在强碱溶液中氧化Fe(OH)3反应可制取Na2FeO4,离子方程式为:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
| B.向某无色溶液中滴加Ba(NO3)2溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42- |
| C.Na+、K+、CO32-、SO42‾可以大量共存,通入CO2不能大量共存 |
D. =1×1012的溶液中Ba2+、Na+、Br‾、NO3-可以大量共存 =1×1012的溶液中Ba2+、Na+、Br‾、NO3-可以大量共存 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验 编号 |
c(HA)起始浓度/(mol·L-1) |
c(KOH)起始浓度/(mol·L-1) |
反应后溶液的pH |
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.0.1 mol·L-1HA的溶液中由水电离出的 c(H+)=1×10-13 mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙
乙+丙
b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为: ;
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是: ;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 (选填编号).
| A.3 mL | B.7.5 mL | C.15 mL | D.27.5 mL |
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为 。
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①写出上述反应的化学方程式 。
②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为 。
③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为 。

【改编】(17分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g)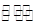 2NH3(g)
2NH3(g)  H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
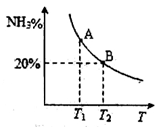
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2(填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,氮气的平衡转化率 (填“增大”、“减小”或“不变”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(NH3)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则V正 V逆(填“>”或“<”或“=”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)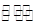 H2O(1)+CO(NH2)2(1)△H,在一定压强下测得如下数据:
H2O(1)+CO(NH2)2(1)△H,在一定压强下测得如下数据:
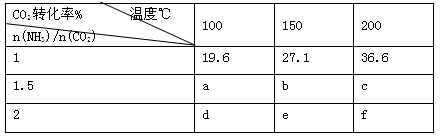
①该反应破坏旧化学键吸收的能量 形成新化学键放出的能量,表中数据a d,b f(均选填“>”、“=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)通入O2氧化时,发生反应的离子方程式为____________________。
(2)滤渣2的成分是_________(填化学式)
(3)流程图中“操作步骤”为 、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热 (填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为 。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为 [25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)]。
(6)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;
MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
①若在实验室中煅烧硫酸镁,需要的仪器除酒精灯、三脚架以外,还需要 。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
②用下列实验装置检验煅烧产生的气体中含有SO2、CO2气体(加热装置略去,部分装置可以重复使用)。

正确的连接顺序是a→b→ (按接口连接)。B中盛放的试剂是 ,确定存在二氧化碳气体的实验现象是 。
【化学与技术】资源开发、材料制备及工农业生产等都离不开化学。请回答下列问题:
(1)工业制肥皂时,在皂化反应结束后需要在混合物中加入饱和食盐水。加入饱和食盐水的目的是 。
(2)Al2O3的熔点高达2050oC,工业上为了降低能量消耗,在金属铝的冶炼中通常采取的措施是 。
(3)工业上合成氨所需的氮气来源于 ,氢气来源于 ,写出工业上在催化剂作用下制取氢气的其中一个化学方程式 。
(4)工业制硫酸时,SO3的生成是在 (填设备名称)中进行的,工业上常采用浓硫酸吸收SO3,而不直接用水吸收的原因是 。在吸收塔中,为提高SO3的吸收率所采取的措施为 。
【改编】【物质结构与性质】决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)N、O、S、Mg、Al五种元素的第一电离能从大到小的顺序为 。
(2)乙醛(CH3- )分子碳原子的杂化方式为 用价层电子对互斥理论推断甲醛中H—C—H的键角 120o(填“>”“<”或“=”)。
)分子碳原子的杂化方式为 用价层电子对互斥理论推断甲醛中H—C—H的键角 120o(填“>”“<”或“=”)。
(3)科学家通过X射线探明,KCl、MgO、CaO的晶体结构与NaCl的晶体结构相似(图a所示)。则KCl、CaO、MgO、I2四种离子晶体熔点从高到低的顺序是 。

(4)设MgO晶胞的边长为acm,则MgO的密度是 g·cm-3(只要求列算式。阿伏加德罗常数为NA)。
(5)某配合物的分子结构如图b所示,其分子内含有 (填字母)。
| A.离子键 |
| B.共价键 |
| C.金属键 |
| D.配位键 |
E.氢键
F. 键
键
【有机化学基础】某芳香族化合物H常用作防腐剂,H可利用下列路线合成:

已知:
①A是相对分子质量为92的烃;

④D的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积之比为1:1。
回答下列问题:
(1)A的分子式为___________,由A→B的反应试剂和反应条件为____________。
(2)写出C→D的反应方程式:_________________________________________。
(3)同时符合下列条件的E的同分异构体共有____________种。
①能发生银镜反应
②能使FeCl3溶液发生显色反应。
(4)检验F中含氧官能团的试剂为____________(填试剂名称),由F→G的反应类型为______。
(5)H的结构简式为_____________________________________。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号