现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
| 阳离子 |
Na+ H+ Ba2+ |
| 阴离子 |
OH- CO32- SO42- |
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的名称:X  。
。
(2)B溶于水后的电离方程式为 。鉴别B中阴离子的实验操作方法是
。
(3)完成以下水溶液中的反应的离子方程式:
A溶液与B溶液反应:
B溶液与E溶液反应:
B与C反应至溶液呈中性:
(4)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为 。
将Fe粉、Cu粉、FeCl3溶液、FeCl2和CuCl2溶液,混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能 ;
(2)若氯化铜有剩余,则容器中还可能有 ;
(3)若氯化铁和氯化铜都有剩余,则容器中不可能有 , 可能有 。
(4)若氯化铁有剩余,则容器中不可能有 。
物质有以下转化关系:
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是 ,B是 ,C是 ,X粉末是 。
(2)写出反应①的化学方程式 。
(3)写出反应②的离子方程式 。
某实验室把学生做完实验后的废液(含氯化钠、氯化铁、氯化铜等)进行集中处理,过程如下:
(1)沉淀D的化学式为 。
(2)反应③中Cl2属于 (填“氧化剂”或“还原剂”)。
(3)写出①反应中的离子方程式
。
(4)溶液C中的溶质是 (提示:加热后,溶液中没有了HCl和Cl2),若要进一步进行分离,方法是 。
有A、B、C、D、E 5种透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3
和AgNO3中的一种。已知:
① A和B反应有气体生成;
② B与C反应有沉淀生成
③ C与D反应有沉淀生成
④ D与E反应有沉淀生成
⑤ A与E反应有气体生成
⑥ 在②和③的反应中生成的沉淀为同一种物质
(1)在②和③反应中生成的沉淀为同一种物质,其化学式为________。
(2)写出各物质的化学式:A ________、B__________、C___________、D_________、E________。.
(3)A和E反应的离子方程式为_____________________________。
(10分) 化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
(1)废液经操作①得到的沉淀A中含有的金属单质是 ;
(2)写出操作①的反应离子方程式 ; 。
(3)在操作②中观察到的实验现象是 。
(4)操作③中发生主要反应的离子方程式为 。
A、B、C、D、E、F是中学化学中常见的气体,G是一种固体非金属单质,它们具有如下的性质:
①A、B、E能使湿润的蓝色石蕊试纸变红,F能使湿润的红色石蕊试纸变蓝,C、D不能使湿润的石蕊试纸变色。
②A和F相遇产生白烟。
③B和E都能使品红溶液褪色。
④将红热的铜丝放入装有B的集气瓶中,瓶内充满棕黄色的烟。
⑤C和D相遇生成红棕色气体,且D可助燃。
⑥G是常见的半导体材料
回答下列问题:
(1)A的化学式是 ,②中的白烟是 (填化学式)。
(2)④中发生反应的化学方程式是
(3)C的化学式是 ,E的化学式是
(4)写出工业上制G的化学方程式
(5)B是一种有毒气体,实验室可用 吸收B,反应的离子方程式是
写出实验室制取B的化学方程式
已知A、D为单质,B、C为化合物,B溶液中滴加硫氰化钾溶液变红色,A的水溶液能使有色布条褪色。
(1)写出A、C的化学式:A ▲ ;C ▲ ;
(2) B与D反应的离子方程式 ▲ 。
根据下面框图填空。已知:物质A的焰色反应呈黄色;物质G是一种白色物质,微溶于水,实验室常用此物质检验二氧化碳气体;D、E为两种气体单质;M是一种合成树脂,常用于制备塑料和合成纤维。
已知碳碳双键与羟基相连的物质很不稳定,自动发生分子内原子重排,有如下变化:
回答:(1)物质C的电子式____________________
(2)写出反应的化学方程式。
反应①_____________ 反应②_________________
反应③_____________ 反应④_________________
下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝,1molX分解得到A、B、C各1mol。
(1)写出下列各物质的化学式:
X: ;B: ;F: ;G: 。
(2)写出下列变化的反应方程式:
A→D: ;
C→E: 。
(3)写出下列变化的离子方程式:
G→E:
G→F:
(4)写出实验室和工业上制C的化学方程式。
已知A、B、C均为常见单质,其中A是金属,B、C是非金属,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。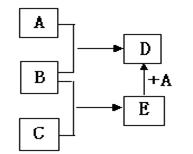
请回答下列问题:
(1)若常温下,B、C均为气体,D为黑色磁性固体,则C的化学式为 , A和E反应生成D的化学方程式为 。
(2)若常温下,B为气体,C为黑色固体粉末,则金属A的原子结构示意图为 , A和E在一定条件下反应生成D的化学方程式为 。
某常见金属X,有下列关系图,其中A、B分别是X的正二价、正三价金属离子,请回答:
(1)写出X的名称 ,Y的化学 式 。
式 。
(2)写出下列反应的化学方程式或离子方程式:
① X和稀盐酸反应生成A和某种气体的离子方程式
② +2价的A被Y氧化反应生成+3价的B的离子方程式
③ X粉末和硫酸铜溶液发生置换反应的离子方程式

④ X的正三价氧化物(X2O3)和铝粉反应的化学方程式
(3)A溶液与NaOH溶液在空气中反应的现象  。
。
并写出有关的化学方程式 。
(15分)有X、Y、Z三种元素,X是有机化合物中必含有的元素,Y是地壳里含量最高的元素,Z是质量最轻的元素,X与Y能结合成两种化合物A和B,A可以燃烧,B不可燃烧也不能支持燃烧,X与Z结合的化合物C是最简单的烃。由X、Y与Z三种元素组成的化合物D常用作实验室加热的燃料。
(1)试判断X、Y、Z各是什么元素(填名称)。X 、Y 、Z 。
(2)试判断A、B、C、D各是什么物质(填化学式)。
A 、B 、C 、D 。
(3)写出化合物A与Fe2O3反应的化学方程式 。
(4)已知常温下8g C在O2中完全燃烧放出444.8kJ的热量,试写出化合物C完全燃烧的热化学方程式: 。
(5)欲用化合物D与Na反应制取并收集1g H2,需要D的质量 g;并写出化合物D与 反应的化学方程式: 。
反应的化学方程式: 。
已知A、B、C、D为常见单质,其中B、C、D常温常压下为气体,甲、乙、丙、丁为常见的化合物,乙常温下为液体,丙的焰色反应为黄色,下图为各种物质之间的转化关系。
请回答下列问题:
(1)写出下列物质的化学式:
B ,D 。
(2)甲的电子式为 ,反应②中若有11.2L(标准状况下)B生成,则发生转移的电子的物质的量为 。
(3)写出反应①的离子方程式: 。
写出反应③的化学方程式: 。
淡黄色固体X和气体A存在如下转化关系:

请回答下列问题:
(1)固体X的名称 A的化学式 。
(2)写出反应①③的化学方程式,并指出氧化剂。
反应① , 。
反应③ , 。
(3)写出②④反应的离子方程式:
反应② 。
反应④ 。