物质A~I之间能发生如下反应(图中部分反应的条件和产物没有全部标出),其中A、B、C、I为金属单质,B是地壳中含量最多的金属,甲、乙、丙为气体。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C__________、H____________。
(2)写出气体甲在气体乙中燃烧的化学方程式:_______________________;
该反应的现象有:______________________________。
(3)写出反应③的化学方程式:______________________;向反应③所得溶液中通入过量的CO2,写出反应的离子方程式:_________________________。
(4)写出反应⑤的离子方程式:____________________;
(5)检验物质D中阳离子的方法名称是:_____________________。
已知某些金属氧化物跟熔融烧碱反应可生成盐。根据下列框图填空。
(1)单质C是______________、化合物H是______________
(2)写出由E生成G的离子反应方程式________________________。
(3)溶液I中所含金属离子是________________________________。
物质A~E均含同种元素,都是中学化学中常见的物质,它们可发生如图所表示的反应。已知A是一种淡黄色的固体,B是银白色金属单质。

(1)反应⑤可用于潜水艇中制取氧气,相关的化学方程式为:__________________,氧化剂是______,还原剂是______;
(2)根据反应②相关的现象,从表格下方找出相应性质序号填在表格中,并在对应的位置写上该反应的化学方程式。
| |
现象 |
单质B的相关性质(填序号) |
相关的化学方程式 |
| I |
单质B浮在水面上 |
|
|
| II |
熔成一个小球 |
|
|
| III |
四处游动,发出嘶嘶的声音 |
|
|
| IV |
滴入酚酞试剂,溶液变红 |
|
与反应现象相应的性质:①反应后生成了酸性物质;②反应后生成了碱性物质;③单质B的熔点低;④单质B的密度比水的小;⑤生成了气体;⑥单质B的密度比水的密度大;
(3)D和E分别与等浓度的盐酸反应,相同条件下生成等体积的气体,则以下说法正确的是:
________(填序号)
①消耗D的质量较多;②消耗E的质量较多;③D消耗盐酸的体积更大 ④E消耗盐酸的体积更大
I:钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。

请回答下列问题:
(1)Fe位于元素周期表中第________周期,第________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
Ⅱ:A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。

试回答:
(1)若X是强氧化性单质,则A不可能是________________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)____________。
(3)A还可以是氨气,氨气分子的空间构型是 。
常见金属单质A可发生如图所示转化(部分反应物、产物和反应条件已略去)。F是一种温室气体;气体G的水溶液显弱碱性;H是一种具有磁性的黑色氧化物;B、C、D、E四种化合物中含有一种相同的元素。
请回答下列问题:
(1)写出F的电子式________________,实验室制取G的化学方程式为______________________。
(2)写出反应I的离子方程式_______________。该反应中的氧化剂是______________________。
(3)反应I、Ⅱ均有清洁能源H2产生。已知H2的燃烧热为286 kJ·mol-1,18 g水蒸气变成液态水放出44 kJ的热量。其它相关数据如下表:
则表中x为______________
(4)写出A与H反应的化学方程式________________________________,实验测得该反应的焓变(△H)和活化能(Ea)。下列能量关系图合理的是_________________(填写序号)。
(5)资料显示H可用于除去地下水中的TcO4-(99Tc具有放射性)。在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为_______________________________。
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容如下:
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:
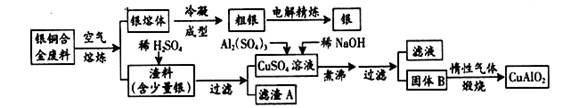
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为____mol CuAlO2(Cu 的相对原子量取63.5),至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(Ⅰ)某盐有原子序数处于前20的三种元素组成,相对分子质量为98,其焰色反应为紫色(透过蓝色的钴玻璃)。向此溶液中滴入少量盐酸时,产生白色沉淀,继续加入过量盐酸时,白色沉淀消失,再滴入过量氨水,又产生白色沉淀。
(1)三种元素中原子序数最小的简单离子的离子结构示意图 ,
(2)该盐的化学式为 ,
(3)该盐溶液滴入少量盐酸的离子方程式 。
(Ⅱ)某二元化合物A是一红棕色难溶物质,温度超过60℃,分解生成红色金属B和无色气体单质C,且两种单质的物质的量之比为2:1,将A与盐酸反应也同样产生气体C。在一定条件下可以用H3PO2与CuSO4溶液混合制备A,经鉴定反应后的溶液是磷酸和硫酸的混合物。且A能在氯气中燃烧。
(1)A的化学式为 ,
(2)写出用H3PO2与CuSO4溶液混合制备A的反应方程式 ;
(3)写出A在氯气中燃烧的方程式 ;
(4)有人认为还有一种组成元素与A相同的二元化合物, 若此物质为离子化合物,则电子式为 ;
(5)A与盐酸能反应的原因 。
(1)某无色溶液含下列8种离子中某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、
HCO3-、NO3-。已知该溶液可与Al2O3反应,则:
① 若溶液与Al2O3反应,有Al3+生成,则溶液一定有________,一定不含有________。
② 若溶液与 Al2O3反应,有AlO2-生成,则溶液一定有________,可能含有________。
(2)有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,
用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E产生沉淀,B与D、B与E产生沉淀,C与E、D与E产生气体,而C与D无反应现象。
由此,可判定各试剂瓶中所盛试剂为:
A________,B________,C________,D________,E________。
海水是巨大的资源宝库.如图1是从海水中提取食盐和溴的主要流程.

(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.如图2是粗盐提纯的操作流程.

提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液.
①除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、
②如何证明操作①中NaOH溶液已经过量?
③蒸发过程所用的主要仪器有:铁架台、酒精灯、 、 ;
(2)某同学欲四氯化碳萃取较高浓度的溴水中的溴,经振荡并在铁架台上静置分层后,分离出四氯化碳层的操作:
(3)工业上将较高浓度的溴水经进一步处理得到工业溴.某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为 59℃,微溶于水,有毒性和强腐蚀性.水的沸点为100℃.他们参观生产过程后,设计了如图3装置简图:

①图中仪器B的名称: ②温度计水银球的位置:
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为:
在如图所示的有关物质转化关系中,各物质均是我们中学化学所学的物质。C为一种黑色粉末,D为一种气体。
请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
(1)若F为可溶性碱,G为蓝色沉淀,则A为_________________;D可能为__________________。
(2)若G为蓝色沉淀,H为难溶性盐,则I为_________________。
(3)若G、H都属于盐,且G为蓝色溶液,则I可能为______________;F可能为_____________。
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。

已知:A为金属单质,B为红褐色固体,E为密度最小的气体,G为浅绿色的溶液。
D的水溶液为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
在水溶液中D能将某氧化物氧化为F,F是含有三种元素的化合物。请回答下列问题:
(1)构成C物质的元素在周期表中的位置是 ,在短周期主族元素中,该元素与其相邻元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)D的水溶液呈 性,请用离子方程式解释原因:
(3)上述反应中属于置换反应的是 (填序号)。
(4)反应③(即D将某种氧化物氧化为F)的离子方程式:
(5)气体C通入KI溶液中,氧化产物为KIO3,则氧化剂与还原剂物质的量之比为
无机化合物A和金属B是中学化学常见的固体,其中A显淡黄色。相同质量的A、B都能与液体C反应放出气体,两气体又能恰好完全反应生成C。利用B在高温下的挥发性,可通过它的碳酸盐和焦炭在真空环境中来制备B。化合物D可作为有机反应中的脱氢试剂,1molD和1mol NH4Cl反应生成2mol气体E和1molB的氯化物。已知标准状况下气体E的密度为0.76g·L-1。
请回答下列问题:
(1)E的化学式为 。
(2)题中制备B的化学方程式为 。下列物质能替代焦炭的是 。
A.Na B.H2 C.KMnO4 D.Cl2
(3)B与E在一定条件下 (填“可能”或“不可能”)直接发生反应产生D,判断理由是 。
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式