已知某些金属氧化物跟熔融烧碱反应可生成盐。根据下列框图填空。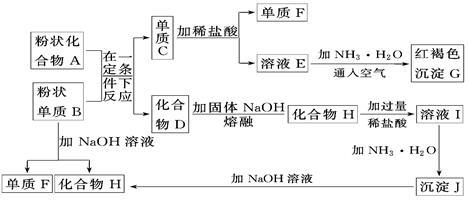
(1)单质C是______________、化合物H是______________
(2)写出由E生成G的离子反应方程式________________________。
(3)溶液I中所含金属离子是________________________________。
已知某些金属氧化物跟熔融烧碱反应可生成盐。根据下列框图填空。
(1)单质C是______________、化合物H是______________
(2)写出由E生成G的离子反应方程式________________________。
(3)溶液I中所含金属离子是________________________________。