河北省承德市联校高一上学期期末联考化学试卷
下列叙述中,说法不正确的是
| A.复分解反应一定都不属于氧化还原反应 |
| B.在氧化还原反应中,金属单质一定不是氧化剂 |
| C.在氧化还原反应中,非金属单质一定是氧化剂 |
| D.置换反应一定都属于氧化还原反应 |
“纳米材料”是当今材料科学研究的前沿,指研究、开发出的直径从几纳米至几十纳米的材料,1纳米(nm)=10—9 m,如果将“纳米材料”分散到液体分散剂中,下列说法一定正确的是
| A.有丁达尔效应 |
| B.不能吸附溶液中悬浮物 |
| C.不能透过滤纸 |
| D.所得分散系不稳定 |
现有下列仪器:烧杯、铁架台(带铁圈)、分液漏斗、酒精灯、玻璃棒、蒸发皿和蒸馏烧瓶,从缺少仪器的角度分析,不能进行的实验项目是
| A.萃取 | B.蒸发 | C.过滤 | D.溶解 |
下列表格中各项分类都正确的一组是:
| 类别 选项 |
纯净物 |
混合物 |
电解质 |
非电解质 |
| A |
生理盐水 |
明矾 |
液态KNO3 |
蔗糖 |
| B |
CaO |
海 水 |
铜 |
乙醇 |
| C |
胆矾 |
铝合金 |
AgCl |
CO2 |
| D |
氢氧化钠 |
空气 |
Na2SO4溶液 |
食醋 |
设NA表示阿伏加德罗常数,下列叙述中正确的是
| A.常温常压下,11.2 L氧气所含的分子数为NA |
B.1.8 g的NH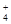 中含有的电子数为NA 中含有的电子数为NA |
| C.常温常压下,48 g O3含有的氧原子数为NA |
| D.24 g金属镁变为镁离子时失去的电子数为NA |
关于如下反应:HgS+O2 Hg+SO2,下列叙述不正确的是
Hg+SO2,下列叙述不正确的是
| A.该反应是置换反应 | B.该反应转移了4e- |
| C.Hg是被还原得到的产物 | D.HgS既是还原剂又是氧化剂 |
在下列溶液中,若加入过量的氢氧化钠溶液,能产生沉淀,若加入铜粉溶液增重的是
| A.MgCl2 | B.FeCl2 | C.AlCl3 | D.FeCl3 |
下列实验操作中错误的是
| A.萃取操作时,应选择密度比水大的萃取剂 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.蒸发操作时,不能等到混合物中的水分完全蒸干后,才停止加热 |
将一严重锈蚀而部分变成铜绿[Cu2(OH)2CO3 ]的铜块研磨成粉末,在空气中充分灼烧到质量不再变化为止,固体质量的变化情况不可能是
| A.不变 | B.增重10% | C.增重30% | D.减轻20% |
制印刷电路板时常用氯化铁溶液作为“腐蚀液”,其反应的化学方程式为Cu+2FeCl3=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
| A.烧杯中有铜无铁 | B.烧杯中铁、铜都无 |
| C.烧杯中铜、铁都有 | D.烧杯中有铁无铜 |
下列关于实验问题处理方法或操作不正确的是
| A.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 |
| B.在实验室,不能品尝药品 |
| C.熄灭实验桌上燃着的酒精,简便合理的方法就是用湿抹布盖灭 |
| D.配制稀硫酸时,先在烧杯中加一定体积的水,再边搅拌边沿杯壁加入浓硫酸 |
下图是某品牌饮用矿泉水的标签的部分内容。下列说法正确的是
| A.标签上给出的离子的物理量是物质的量浓度 |
| B.任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L 之内 |
| C.该品牌饮用矿泉水中c(Mg2+)最大值为2×10—4 mol/L |
| D.一瓶该品牌饮用矿泉水中SO42-的物质的量不超过1×10—5 mol |
下列叙述中,正确的是
| A.0.3 mol/L的Na2SO4溶液中含有Na+ 和SO42-的总物质的量为0.9 mol |
| B.当1 L水吸收标准状况下的22.4 L氯化氢时所得盐酸的浓度是1 mol/L |
| C.在K2SO4和NaCl的中性混合水溶液中,如果Na+ 和SO42-的物质的量相等,则K+ 和Cl—的物质的量浓度一定相同 |
| D.10 ℃时,0.35 mol/L的KCl饱和溶液100 mL蒸发掉5 g水,恢复到10 ℃时,它的物质的量浓度仍为0.35 mol/L |
下列化学反应的离子方程式,书写不正确的是
| A.硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-= BaSO4↓ |
B.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH—=AlO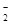 +2H2O +2H2O |
| C.氯化亚铁溶液中通入少量氯气:Cl2+ 2Fe2+=2Fe3+ +2Cl— |
| D.碳酸钙加入稀盐酸: CaCO3+2H+=Ca2+ +CO2↑+H2O |
(1)下面是唐朝刘禹锡描写沙里淘金的一首诗,其中有的诗句可能包含了化学实验现象或化学实验过程,请在这样的诗句后面写出相应的实验现象或实验过程。
日照澄洲江雾开,
淘金女伴满江隈。
美人首饰王侯印,
尽是沙中浪底来。
(2)某小苏打溶液中含NaHCO3有16.8 g,加入一定物质的量的单质或化合物X,恰好使溶液中溶质只有Na2CO3,且无沉淀产生。请你填写出X的化学式和物质的量。
例如: X为NaOH 时,物质的量为0.2 mol ;
①X为 时,物质的量为 ;
②X为 时,物质的量为 ;
A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是 、S
、S 、Cl—、C
、Cl—、C 的某一种。
的某一种。
(1)若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。
根据(1) 、(2)实验事实可推断它们的化学式为:
A. B. C. D.
“比较法”是化学研究的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如: 2Na2O2+2CO2=2Na2CO3+O2, Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、Na2O2与SO3(g)反应的化学方程式:
、
(2)当1 mol SO3(g)参加反应时,转移电子的物质的量为 mol。
(3)通过比较可知:在氧化物中,当非金属元素处于 (填“最低”、“中间”或“最高”)价时,其氧化物与过氧化钠反应就有O2生成。
已知A、B、C均为常见单质,其中A是金属,B、C是非金属,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。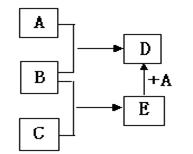
请回答下列问题:
(1)若常温下,B、C均为气体,D为黑色磁性固体,则C的化学式为 , A和E反应生成D的化学方程式为 。
(2)若常温下,B为气体,C为黑色固体粉末,则金属A的原子结构示意图为 , A和E在一定条件下反应生成D的化学方程式为 。
下图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________(填编号)。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
| C.溶液中Cl—的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.40 mol/L的稀盐酸。
①该学生需要量取 mL(精确到小数点后一位)上述浓盐酸进行配制。
②现有a.10 mL量筒;b. 25 mL量筒;c.烧杯;d.托盘天平;e. 500 mL容量瓶;f.胶头滴管;g.玻璃棒,请从其中选取必要的仪器,按各仪器第一次使用先后顺序排序: (填编号)。
③在配制过程中,下列实验操作对所配制盐酸物质的量浓度有何影响?(在空格中填 “偏高”、“偏低”或“无影响”):
定容时俯视观察_________;
定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水__________。
某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成。请完成对该白色粉末成分的探究(可供选用的实验仪器及试剂如下)。
(1)提出合理假设
假设1:该白色粉末成分为碳酸钠;
假设2:该白色粉末成分为亚硫酸钠;
假设3: 。
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成,其最佳连接顺序是:a— (每组选用仪器和试剂限用一次)。
(3)根据(2)的连接顺序进行实验,填写相应现象。
| 假设方案编号 |
相应现象 |
| 假设1 |
|
| 假设2 |
|
| 假设3 |
|
由铝和某些金属氧化物组成的混合物在化学上称为铝热剂,该混合物在高温条件下能发生置换反应。为确定某铝热剂样品(铝和氧化铁)的组成,分别进行下列实验:
(1)若取10.7 g该样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为a L。反应的化学方程式是 ,样品中铝的质量分数是 (用含a的表达式表示)。
(2)若取同质量的样品,在高温下使其恰好反应,则a = L;该反应的化学方程式是 。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为b L,该气体与(1)中所得气体的体积比a∶b =_______。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号