下列叙述正确的是
| A.等质量的铜分别与足量稀硝酸和浓硝酸充分反应,生成气体的物质的量相同 |
| B.等质量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同 |
| C.等质量的铝分别与足量氢氧化钠溶液和盐酸充分反应,生成气体的体积一定相同 |
| D.等质量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同 |
X是短周期中原子半径最小的元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;
(1)Y的原子结构示意图是_______________.
(2)甲的水溶液与硫酸铝溶液反应离子方程式 .
(3)甲与氯化氢反应生成乙.乙所含化学键类型有 .在0.1mol•L﹣1乙溶液中,所含离子浓度由大到小的顺序是 .
(4)工业上,可通过如下转化制得尿素晶体:
①Ⅰ中恒温恒容条件下,能同时提高化学反应速率和NH3产率的是 。
②反应Ⅱ:2NH3(g)+ CO2(g)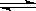 CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
(i)此反应的平衡常数表达式K= 。升高温度,K值 (填增大、减小或不变)。
(ii)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。
已知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 =" -1806.4" kJ·mol-1
写出CO(NH2)2(g)与NO反应的热化学方程式 。
短周期元素N、Na、Al形成的物质在工农业生产、生活中应用广泛。
(1)Al在元素周期表中的位置为 ;其原子半径比Na (填“大”或“小”)。
(2)Al单质在空气中不易腐蚀,原因是其表面形成了一种致密的且熔点高的化合物。该化合物的晶体类型为 ;该化合物遇酸碱易被腐蚀,请写出它与NaOH溶液反应的离子方程式 。
(3)NH3的电子式为 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是 。
(4)标准状况下22.4L NH3与0.5L 1mol/L 氮元素的最高价氧化物的水化物反应,所得溶液中离子浓度由大到小的顺序是 。
(5)NF3是一种新型电子材料,常温下为稳定气体,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和某种物质。请写出反应的化学方程式 。
电解NO制备NH4NO3,其工作原理如图所示,下列说法不正确的是
| A.b极的电极反应为:NO-3e-+4OH-=NO3-+2H2O |
| B.溶液中的H+由电极b处向电极a处迁移 |
C.电解过程总反应的化学方程式为:8NO+7H2O 3NH4NO3+2HNO3 3NH4NO3+2HNO3 |
| D.为使电解产物全部转化为NH4NO3,需补充的物质 A是NH3 |
在酸性Fe(NO3)3溶液中逐渐通入H2S气体,可能发生的离子反应是
| A.H2S + 2NO3-+ 2H+ → 2NO2↑+ S↓+ 2H2O |
| B.3 H2S + 2NO3-+ 2H+ → 2NO↑+ 3S↓+ 4H2O |
| C.3Fe3++ 3NO3-+ 6H2S →3NO↑+ 6S↓+ 3Fe2++6H2O |
| D.Fe3++3NO3- + 5H2S+ 2H+ →3NO↑+ 5S↓+ Fe2++6H2O |
某课外活动小组的同学从采集器中获得雾霾颗粒样品,然后用蒸馏水溶解,得到可溶性成分的浸取液。在探究该浸取液成分的实验中,下列根据实验现象得出的结论错误的是
| A.取浸取液少许,滴入AgNO3溶液有白色沉淀产生,则可能含有Cl- |
| B.取浸取液少许,加入Cu和浓H2SO4,试管口有红棕色气体产生,则可能含有NO3- |
| C.取浸取液少许,滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,则一定含SO42- |
| D.用洁净的铂丝棒蘸取浸取液,在酒精灯外焰上灼烧,焰色呈黄色,则一定含有Na+ |
氯化亚铜(
)广泛应用于化工、印染、电镀等行业。
难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是
和少量
)为原料,采用硝酸铵氧化分解技术生产
的工艺过程如下: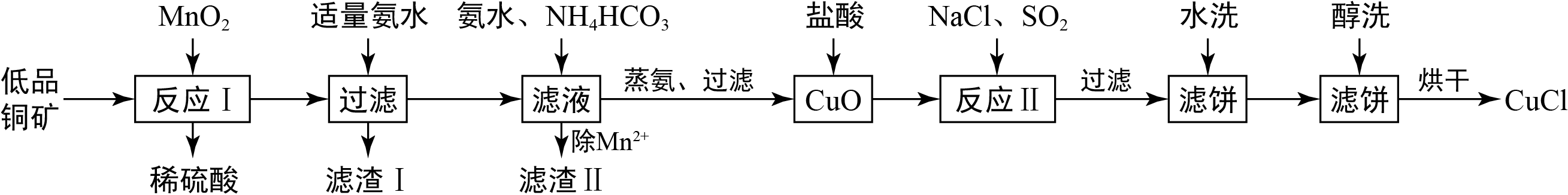
回答下列问题:
(1)步骤①中得到的氧化产物是,溶解温度应控制在60~70度,原因是。
(2)写出步骤③中主要反应的离子方程式。
(3)步骤⑤包括用
=2的酸洗、水洗两步操作,酸洗采用的酸是(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有(填字母)
| A. | 分馏塔 | B. | 离心机 | C. | 反应釜 | D. | 框式压滤机 |
(6)准确称取所制备的氯化亚铜样品 ,将其置于若两的 溶液中,待样品完全溶解后,加入适量稀硫酸,用 的 溶液滴定到终点,消耗 溶液 ,反应中 被还原为 ,样品中 的质量分数为。
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为
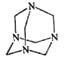
| A. | 1∶1 | B. | 2∶3 | C. | 3∶2 | D. | 2∶1 |
将和
的混合气体448
通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8
气体。原混合气体中
的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)
| A. |
231.5
|
B. |
268.8
|
C. |
287.5
|
D. |
313.6
|
(本题共12分)南美洲干旱地区有智利硝石,是制取炸药的重要原料,其主要成分是NaNO3,还含少量NaIO3等可溶盐和不溶物。NaNO3溶于水时溶液的温度降低。
36.以下操作可从智利硝石分离出NaNO3:溶解、______________________________。
37.用NaNO3和浓硫酸反应可以制取硝酸,反应的化学方程式为____________________;
热的硝酸会腐蚀橡胶,制取装置中应该用____________________________________代替胶管和胶塞。
38.分离出的NaIO3可通过以下反应制得I2: 4NaIO3+10NaHSO3→7Na2SO4+3H2SO4+2I2+2H2O
简述从反应后得到的混合物中分离出I2:的操作___________________________________。
NaHSO3过多或过少,I2的产率都会降低,当NaIO3与NaHSO3的物质的量之比为1:2.6时,I2的产率为________________。
39.智利硝石资源有限(曾引起过南太平洋战争),现在工业上制NaNO3主要采用化学合成的方法,涉及的工业制备有(请结合课本知识回答)____________、制硝酸、__________等;写出工业制硝酸的化学方程式________________________、_______________________。
如图所示,集气瓶内充满某混合气体,置于光亮处一段时间后,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,则集气瓶内气体是
①CO、O2 ②C12、CH4 ③NO2、O2 ④N2、H2
| A.①② | B.②④ | C.②③ | D.③④ |
中新网报道美国准备试验绿色航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验。羟基硝酸铵的结构如图所示,下列说法不正确的是
| A.固态时羟基硝酸铵是离子晶体 |
| B.羟基硝酸铵中各原子共平面 |
| C.羟基硝酸铵中含有离子键和共价键 |
| D.9.6g羟基硝酸铵中含有0.2NA个离子 |
(14分)近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
①在图示的转化中,被还原的元素是 ,X的化学式为 。
②SCR技术可使NOx与NH3的直接反应,实现无害转化。当NO与NO2的物质的量之比为4:1时,写出发生反应的化学方程式: 。
(2)加入过量次氯酸钠可使废水中NH4+完全转化为N2,而本身被还原为NaCl。
①写出上述反应的离子方程式: 。
②若处理废水产生了0.448 L N2(标准状况),则需消耗浓度为0.5 mol·L—1的次氯酸钠的体积为 mL。
(3)某工业废水中含有毒性较大的CN—,可用电解法将其转变为N2,装置如图所示。气体甲是 (写化学式),电解池中生成N2的电极反应式为 。
(15分)颗粒大小达到纳米级的单质铁俗称“纳米铁”,可用作手机辐射屏蔽材料。实验室的制备方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2反应生成“纳米铁”,实验装置如下图。请回答:
(1)A装置用于制取氮气,反应的化学方程式为_________。
(2)实验时,应先将____(填“N2”或“H2”)通入C装置,反应生成“纳米铁”的化学方程式为 ;实验中需要保护气的原因是_________。
(3)a导管口的气态产物除HC1外还可能有_________(填化学式)。
(4)利用D装置也可以得到较纯净的氮气。但科学家发现,采用此方法在b导管口得到的氮气在相同条件下比原方法得到的氮气密度略大,原因是_________(假设上述实验设计与操作均无错误,且氮气已完全干燥);若开始加入的铜粉质量为3.84 g,持续通人空气至铜粉全部反应,冷却后固体质量为4.48 g,则固体的成分为_________,反应的化学方程式为_____.