山东省威海市高三第二次高考模拟化学试卷
X、Y、Z、W四种短周期元素,原子序数依次增大。其中X的最外层电子数是最内层电子数的2倍,Y可形成双原子和三原子气体单质,Z和W形成的化合物中离子个数比为1:1,W的最高正价为+7价。则下列说法正确的是
| A.Y形成的简单离子半径小于Z形成的简单离子半径 |
| B.X的氢化物稳定性弱于Y的氢化物稳定性 |
| C.四种元素中,W的氧化物对应的水合物酸性最强 |
| D.Y与Z形成的两种化合物中所含有化学键类型相同 |
下列叙述Ⅰ和叙述II均正确并且有因果关系的是
| 选项 |
叙述I |
叙述II |
| A |
油脂和淀粉都可发生水解反应生成小分子物质 |
油脂和淀粉都属于高分子化合物 |
| B |
煤干馏可得到苯,石油分馏可得到己烷 |
干馏和分馏都属于化学变化 |
| C |
海轮金属外壳上和地下输油铁管道镶入锌块 |
形成原电池,锌作负极失去电子,称为牺牲阳极保护法 |
| D |
硅和二氧化硅的熔点高、硬度大 |
硅可用于制造半导体,二氧化硅可用于制造光导纤维 |
下列叙述正确的是
| A.等质量的铜分别与足量稀硝酸和浓硝酸充分反应,生成气体的物质的量相同 |
| B.等质量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同 |
| C.等质量的铝分别与足量氢氧化钠溶液和盐酸充分反应,生成气体的体积一定相同 |
| D.等质量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同 |
下列装置正确的是
| A.甲装置可用来检验CH3COOH、H2CO3、H2SiO3酸性的强弱 |
| B.乙装置可用来制取并收集氯气 |
| C.丙装置可用来分离氢氧化铁胶体中的胶体粒子 |
| D.丁装置可用来配制一定物质的量浓度的稀硫酸 |
某有机物M的结构简式如下,下列关于该有机物的说法正确的是
| A.M的相对分子质量是178 |
| B.M有机物中含有2种官能团 |
| C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H9O5Na |
D. 与M互为同分异构体 与M互为同分异构体 |
下列说法正确的是
| A.将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干可得到原溶质 |
| B.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3===2NaIO3+Cl2不能发生 |
| C.在新制氯水中各微粒浓度的关系为:2c(Cl2)=c(ClO‾)+c(Cl‾)+c(HClO) |
| D.用1L 0.2 mol·L-1NaOH溶液分别吸收0.1molSO2、0.1mol CO2,所得的两种溶液中酸根离子浓度大小关系是:c(SO32- )>c(CO32-)>c(HCO3-) >c(HSO3-) |
往1.0 mol·L-1KI溶液中加入固体I2,发生反应:I2(aq)+I-(aq) I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
| A.该反应的△H>0 |
| B.a、c两点对应的I-反应速率相等 |
| C.b点时0~10s I-的平均反应速率为0.04mol·L-1·s-1 |
| D.d点时该反应在对应温度下处于平衡状态 |
运用化学反应原理分析解答以下问题。
(1)弱酸在水溶液中存在电离平衡,部分0.1 mol·L-1弱酸的电离平衡常数如下表:
| 弱酸 |
电离平衡常数(25℃) |
| HClO |
K=2.98×10-8 |
| H2CO3 |
K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 |
K1=1.54×10-2 K2=1.02×10-7 |
①当弱酸的浓度一定时,升高温度,K值______(填“变大”、“变小”或“不变”)。
②下列离子方程式和有关说法错误的是 。
a.少量的CO2通入次氯酸钠溶液中:2ClO-+ H2O + CO2 =" 2HClO" + CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-= 2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)< c(NaClO)< c(Na2SO3)
d.相同温度时,等物质的量浓度三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3) >V(H2SO3) >V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性。往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式: ,该反应的氧化产物是 。
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放。
①在废水中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正反应方向移动,则下列说法正确的是 。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正反应方向移动,则下列说法正确的是 。
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH‾(aq)
Cr3+(aq)+3OH‾(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
(3)已知:①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的化学平衡常数K= L4·mol-4(用含a1、a2、a3的代数式表示)。向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的2/3,则CO的转化率_________。
CH3OCH3(g)+CO2(g)的化学平衡常数K= L4·mol-4(用含a1、a2、a3的代数式表示)。向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的2/3,则CO的转化率_________。
可以利用氧化锌粗品(含有Fe2O3、FeO、CuO)为原料制备纯净的氧化锌,其化学工艺流程如下:
按要求回答下列问题:
(1)加双氧水主要作用是氧化溶液中的Fe2+,该反应的离子方程式为___________。
(2)调节pH主要是使溶液中的Fe3+生成沉淀而被除去,溶液pH对除Fe效率影响如图所示。则除Fe3+时应控制溶液的pH为 (填序号)。
a.3.5~4.0 b.2.5~3.5
c.1.5~2.5 d.0.5~1.5
(3)固体b为_________(填化学式),固体c为碱式碳酸锌,锻烧固体c的化学方程式为__________。
(4)工业上也可以将氧化锌粗品采用碱溶的方法,将氧化锌转化为Na2[Zn(OH)4]溶液,然后电解该溶液制取锌,以石墨为电极电解时,阴极的电极反应式为___________,当生成1mol锌时,阳极上生成气体在标准状况下的体积为__________L。“纸质电池”的纸片内充入的是水和氧化锌组成的电解液,纸的一边镀锌另一边镀二氧化锰,电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH),该电池的负极反应式为_________。
氯化亚砜(SOCl2)为无色或浅黄色发烟液体,易挥发,遇水分解,其制取过程的相关反应如下:
S(s)+Cl2(g) SCl2(l) (Ⅰ)
SCl2(l) (Ⅰ)
SCl2(l)+SO3(l)===SOCl2(l)+ SO2(g) (Ⅱ)
已知二氯化硫(SCl2)熔点-78°C,沸点59°C,下图是实验室由氯气与硫合成二氯化硫的装置。
(1)仪器组装完成后,首先进行的一步操作是 ;反应前要先排尽系统中空气,此做法目的是 。
(2)装置B盛放的药品是 ,装置D中玻璃仪器的名称是 ,向其中放入一定量的硫粉,加热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,这样做的优点是 。
(3)实验时,为防止E中液体挥发,可采取的措施是______。装置F(盛放碱石灰)有两个作用:一是吸收多余的氯气,另一个是 。
(4)工业上以硫黄、液氯和液体三氧化硫为原料,能生产高纯度(99%以上)氯化亚砜,为使三种原料恰好完全反应,三者的物质的量比为______;氯化亚砜遇水易分解,请设计简单的实验来验证氯化亚砜与水完全反应的产物,简要说明实验操作、现象和结论______。
已知:SOCl2+4NaOH=Na2SO3+2NaCl+2H2O
供选择的试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液、品红溶液
选做【化学—化学与技术】工业上一种制备氯化铁及高铁酸钾的工艺流程如下: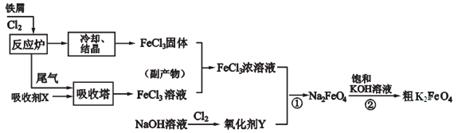
(1)吸收塔中的吸收剂X是 ;从副产物FeCl3溶液中获得FeCl3·6H2O的操作是 、加热浓缩、再冷却结晶。
(2)用FeCl3溶液(副产物)腐蚀印刷线路板所得的废液中含FeCl3、FeCl2和CuCl2,用化学方法可以回收废液中铜;合并过滤后的剩余液体可以作为上述工艺流程中的吸收剂X。则在此过程中,先后加入的物质分别是 。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因: 。K2FeO4在水溶液中易发生反应:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑,在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH-+3O2↑,在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
a.H2O
b.稀KOH溶液、异丙醇
c.NH4Cl溶液、异丙醇
d.Fe(NO3)3溶液、异丙醇
选做【化学物质结构与性质】右图a~f分别表示由H、C、N、Na、Si、Cu元素组成的单质,其中c、d均为热和电的良导体。单质分别对应的熔点如图所示:
(1) 从电负性角度分析,C、Si和N元素的非金属活泼性由强至弱的顺序为 ;
从电负性角度分析,C、Si和N元素的非金属活泼性由强至弱的顺序为 ;
(2)图中d单质对应元素原子的电子排布式 。用价层电子对互斥理论推断,单质a、b、f对应的元素以原子个数比1:1:1形成的分子中化学键的键角为 。
(3)a与b的元素形成的10电子中性分子X,X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为 。
(4)上述六种元素中的一种元素形成的含氧酸分子的结构模型(原子共平面)如图:
则可判断该元素原子(中心原子)的杂化方式是 。氮化硅是一种高温陶瓷材料,硬度大、熔点高、化学性质稳定,其基本结构单元如图,则其化学式为_______。
 )是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如下:
)是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如下:

 粤公网安备 44130202000953号
粤公网安备 44130202000953号