运用化学反应原理分析解答以下问题。
(1)弱酸在水溶液中存在电离平衡,部分0.1 mol·L-1弱酸的电离平衡常数如下表:
| 弱酸 |
电离平衡常数(25℃) |
| HClO |
K=2.98×10-8 |
| H2CO3 |
K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 |
K1=1.54×10-2 K2=1.02×10-7 |
①当弱酸的浓度一定时,升高温度,K值______(填“变大”、“变小”或“不变”)。
②下列离子方程式和有关说法错误的是 。
a.少量的CO2通入次氯酸钠溶液中:2ClO-+ H2O + CO2 =" 2HClO" + CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-= 2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)< c(NaClO)< c(Na2SO3)
d.相同温度时,等物质的量浓度三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3) >V(H2SO3) >V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性。往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式: ,该反应的氧化产物是 。
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放。
①在废水中存在平衡:2CrO42-(黄色)+2H+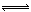 Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正反应方向移动,则下列说法正确的是 。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正反应方向移动,则下列说法正确的是 。
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)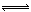 Cr3+(aq)+3OH‾(aq)
Cr3+(aq)+3OH‾(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
(3)已知:①CO(g)+2H2(g)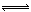 CH3OH(g)
CH3OH(g)
②2CH3OH(g)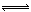 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g)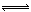 CO2(g)+H2(g)
CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应3CO(g)+3H2(g)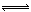 CH3OCH3(g)+CO2(g)的化学平衡常数K= L4·mol-4(用含a1、a2、a3的代数式表示)。向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的2/3,则CO的转化率_________。
CH3OCH3(g)+CO2(g)的化学平衡常数K= L4·mol-4(用含a1、a2、a3的代数式表示)。向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的2/3,则CO的转化率_________。

 2C(g) ,在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。试回答下列问题:
2C(g) ,在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。试回答下列问题: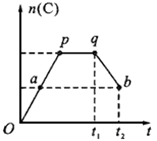
 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2mol/L。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号