2015年全国统一高考理综试卷(新课标Ⅰ卷)化学部分
我国清代《本草纲目拾遗》中记叙无机药物335种,其中"强水"条目下写道:"性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。"这里的"强水"是指
| A. | 氨水 | B. | 硝酸 | C. | 醋 | D. | 卤水 |
NA为阿伏伽德罗常数的值。下列说法正确的是()
| A. | 18 和18 中含有的质子数均为10 |
| B. | 2 0.5 亚硫酸溶液中含有的 两种数为2 |
| C. | 过氧化钠与水反应时,生成0.1 氧气转移的电子数为0.2 |
| D. | 密闭容器中 与1 充分反应,产物的分子数为2 |
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为
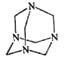
| A. | 1∶1 | B. | 2∶3 | C. | 3∶2 | D. | 2∶1 |
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是()
| 选项 |
实 验 |
现 象 |
结 论 |
| A. |
将稀硝酸加入过量铁粉中,充分反应后滴加
溶液 |
有气体生成,溶液呈血红色 |
稀硝酸将 氧化为 |
| B. |
将铜粉加
溶液中 |
溶液变蓝、有黑色固体出现 |
金属铁比铜活泼 |
| C. |
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 |
熔化后的液态铝滴落下来 |
金属铝的熔点较低 |
| D. |
将
溶液滴入
溶液至不再有沉淀产生,再滴加
溶液 |
先有白色沉淀生成后变为浅蓝色沉淀 |
的溶度积比
的小 |
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是()
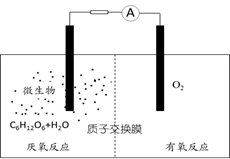
| A. | 正极反应中有 生成 |
| B. | 微生物促进了反应中电子的转移 |
| C. | 质子通过交换膜从负极区移向正极区 |
| D. | 电池总反应为 |
、 、 、 均为短周期主族元素,原子序数依次增加,且原子核外 电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是
| A. | 单质的沸点: > |
| B. | 阴离子的还原性: > |
| C. | 氧化物的水化物的酸性: < |
| D. | 与 不能存在于同一离子化合物中 |
浓度均为0.10 、体积均为 的 和 溶液,分别加水稀释至体积 , 随 的变化如图所示,下列叙述错误的是()
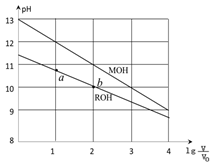
| A. | 的碱性强于 的碱性 |
| B. | 的电离程度: 点大于 点 |
| C. | 若两溶液无限稀释,则它们的 相等 |
| D. | 当 =2时,若两溶液同时升高温度,则 增大 |
草酸(乙二酸)存在于自然界的植物中,其
=5.4×10-2,
=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(
)无色,熔点为101
,易溶于水,受热脱水、升华,170
以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置
中可观察到的现象是,由此可知草酸晶体分解的产物中有。装置
的主要作用是。
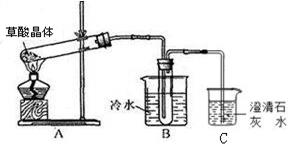
(2)乙组同学认为草酸晶体分解的产物中含有
,为进行验证,选用甲组实验中的装置
、
和下图所示的部分装置(可以重复选用)进行实验。
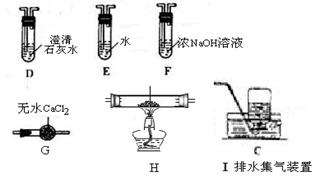
①乙组同学的实验装置中,依次连接的合理顺序为
、
、。装置H反应管中盛有的物质是。
②能证明草酸晶体分解产物中有
的现象是。
(3)设计实验证明:
①草酸的酸性比碳酸的强。
②草酸为二元酸。
硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为
和
,还有少量
、
、
、
和
等)为原料制备硼酸(
)的工艺流程如图所示:
回答下列问题:
(1)写出
与硫酸反应的化学方程式。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有(写出两条)。
(2)利用的磁性,可将其从"浸渣"中分离。"浸渣"中还剩余的物质是(写化学式)。
(3)"净化除杂"需先加
溶液,作用是。然后再调节溶液的
约为5,目的是。
(4)"粗硼酸"中的主要杂质是填名称)。
(5)以硼酸为原料可制得硼氢化钠(
),它是有机合成中的重要还原剂,其电子式为。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程。
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加
和
,即可得到
,该反应的还原产物为。
(2)上述浓缩液中含有
、
等离子,取一定量的浓缩液,向其中滴加
溶液,当
开始沉淀时,溶液中
为:,已知
=1.8×10-10,
=8.5×10-17。
(3)已知反应
的
,1
、1
分子中化学键断裂时分别需要吸收436
、151
的能量,则1
分子中化学键断裂时需吸收的能量为
。
(4)
研究了下列反应:

在716
时,气体混合物中碘化氢的物质的量分数
与反应时间
的关系如下表:
| 0 |
20 |
40 |
60 |
80 |
120 |
|
| 1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
|
| 0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:。
②上述反应中,正反应速率为
正=
正·
,逆反应速率为
逆=
逆·
,其中
正、
逆为速率常数,则
逆为(以
和
正表示)。若
正 = 0.0027
,在
=40
时,
正=
③由上述实验数据计算得到
正~
和
逆~
的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母)

氯化亚铜(
)广泛应用于化工、印染、电镀等行业。
难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是
和少量
)为原料,采用硝酸铵氧化分解技术生产
的工艺过程如下: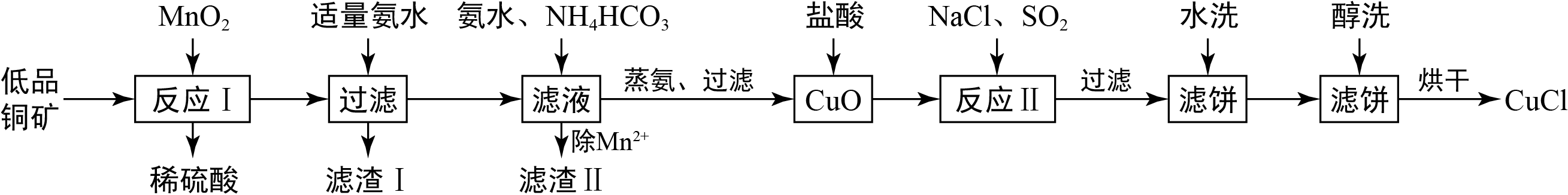
回答下列问题:
(1)步骤①中得到的氧化产物是,溶解温度应控制在60~70度,原因是。
(2)写出步骤③中主要反应的离子方程式。
(3)步骤⑤包括用
=2的酸洗、水洗两步操作,酸洗采用的酸是(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有(填字母)
| A. | 分馏塔 | B. | 离心机 | C. | 反应釜 | D. | 框式压滤机 |
(6)准确称取所制备的氯化亚铜样品 ,将其置于若两的 溶液中,待样品完全溶解后,加入适量稀硫酸,用 的 溶液滴定到终点,消耗 溶液 ,反应中 被还原为 ,样品中 的质量分数为。
物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用形象化描述。在基态原子中,核外存在对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是。
(3)
分子中,共价键的类型有,
原子的杂化轨道类型是,写出两个与
具有相同空间构型和键合形式的分子或离子。
(4)
能与金属
形成
,该化合物的熔点为253
,沸点为376
,其固体属于晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
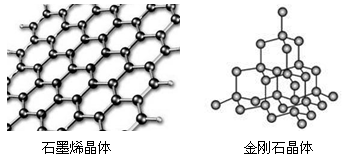
①在石墨烯晶体中,每个
原子连接个六元环,每个六元环占有个C原子。
②在金刚石晶体中,
原子所连接的最小环也为六元环,每个
原子连接个六元环,六元环中最多有个
原子在同一平面。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号