下列各实验中,有关浓盐酸作用的表述错误的是
| A.配制CuCl2溶液时,将CuCl2(s) 溶于浓HCl后再加水冲稀。浓盐酸作用:有利于抑制CuCl2水解,可防止Cu(OH)2的形成。 |
| B.加热MnO2的浓HCl溶液制取氯气。浓盐酸作用:有利于减少氯气的溶解损失。 |
| C.浓硝酸不能溶解金,需用浓HCl溶液配制王水才能溶解金。浓盐酸作用:有利于增强Au的还原性,并且提高硝酸的氧化性。 |
| D.将浓硫酸滴入浓盐酸中制备HCl气体。浓盐酸作用:增大溶质的浓度,有利于促进平衡向气体溶解的逆方向移动 |
下列溶液中有关物质的量浓度关系正确的是( )
A.0.1 mol/L pH=3的H2A溶液与0.01 mol/L pH=11的MOH溶液任意比混合:
c(H+)+c(M+)=c(OH-)+2c(A2-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
下列有关0.1mol·L-1NaHCO3溶液中浓度关系式正确的是
| A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| B.c(Na+)> c(CO32-) > c(HCO3-) > c(OH-) >c(H+) |
| C.c(Na+)= c(HCO3-)+2 c(CO32-)+ c(H2CO3) |
| D.c(Na+)+ c(H+)= c(HCO3-)+2 c(CO32-)+ c(OH-) |
已知某酸H2B在水溶液中存在下列关系:
①H2B===H++HB-,②HB-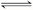 H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.c(Na+)=c(HB-)+c(B2-)+c(H2B)
D.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O
25℃时,醋酸、次氯酸、亚硝酸的电离常数如下表,下列叙述不正确的是
| 酸 |
醋酸 |
次氯酸 |
亚硝酸 |
| 电离常数 |
1.7×10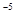 |
3.0×10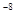 |
7.1×10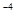 |
A.PH相同的氯水和亚硝酸溶液,水电离出的C(H+)相同
B.往氯水滴加NaOH溶液呈中性:C(Na+)=2C(ClO-)+C(HClO)
C.浓度相等的CH3COONa和NaNO2两份溶液中:C(CH3COO-)>C(NO2-)
D.向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能
已知常温下KHSO3溶液的pH<7,且等浓度的HSO3-的电离程度大于SO32-的水解程度。等物质的量的KHSO3、K2SO3、K2SO4溶于足量水形成的溶液中,有关粒子之间的关系正确的是
| A.c(SO42-)>c(HSO3-)>c(SO32-) >c(H2SO3) |
| B.c(K+)>c(SO32-)>c(SO42-)>c(HSO3-)>c(H+)>c(OH-) |
| C.c(K+)=c(HSO3-)+2c(SO32-)+2c(SO42-) |
| D.c(K+)+c(H+)=c(HSO3-)+c(SO32-)+c(SO42-)+c(OH-) |
在体积均为1 L,pH均等于2的盐酸和醋酸溶液中,分别投入0.23 g Na,则下图中比较符合反应事实的曲线是( )
已知反应:BeCl2+Na2BeO2+2H2O===2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是( )
| A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO |
| B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能为Be(OH)2 |
| C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 |
| D.BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
下列有关说法正确的是( )
| A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S) |
| B.常温下,0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+) |
| C.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时, 溶液中  的值增大到原来的10倍 的值增大到原来的10倍 |
| D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中: |
c(Na+)=c(CH3COOH)>c(CH3COO—)>c(H+)=c(OH—)
下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
下列说法正确的是( )
| A.pH=12的NaOH溶液中,c(H+)=10-12 mol·L-1,稀释为原体积的10倍后c(H+)=mol·L-1=10-13mol·L-1 |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液因生成的CH3COONa水解,pH>7 |
| C.pH=3的HA酸溶液中c(H+)=10-3 mol·L-1,稀释为原体积的10倍后pH≤4 |
| D.pH=11和pH=13的NaOH溶液等体积混合后,溶液中的c(H+)=mol·L-1 |
今有室温下四种溶液,有关叙述不正确的是( )
| |
① |
② |
③ |
④ |
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 |
| B.分别加水稀释10倍,四种溶液的pH:①>②>④>③ |
| C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb=11 ∶9 |
下列说法正确的是
A.某温度时, 1LpH=6的水溶液,含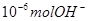 离子 离子 |
B.含10.6gNa2CO3溶液中,所含阴离子总数等于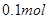 |
| C.VLamol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3mol。 |
D.电解精炼粗铜时,每转移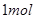 电子,阳极上溶解的 电子,阳极上溶解的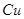 原子数必为 原子数必为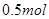 |
25℃时,pH=13的氨水中由水电离出的c(H+)=a,pH=1的盐酸中由水电离出的c(H+)=b,0.2 mol·L-1盐酸与0.1 mol·L-1氢氧化钠溶液等体积混合后,由水电离出的c(H+)=c,则a、b、c的关系正确的是( )
| A.a>b=c | B.a=b=c |
| C.c>a=b | D.a>c>b |