常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+) >c(OH-)=c(H+) |
| D.0.2mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
关于小苏打水溶液的表述正确的是
| A.c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3) |
| B.c(Na+)+c(H+) = c(HCO3-) + c(CO32-) + c(OH-) |
| C.HCO3-的电离程度大于HCO3-的水解程度 |
| D.存在的电离有:NaHCO3 = Na++ HCO3-,HCO3- = H++ CO32- |
下列叙述中正确的是
| A.向体积为Va的0.02 mol·L-1 CH3COOH溶液中加入体积为Vb的0.02 mol·L-1 NaOH溶液,Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(Na+) |
| B.将0.2 mol·L-1的盐酸与0.1 mol·L-1的KAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) |
| C.pH=5的HCOOH溶液和pH=5的NH4NO3溶液中,c(H+)不相等 |
| D.25 ℃时,pH=4,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42﹣)+c(OH﹣) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl﹣)=c(I﹣) |
| C.CO2的水溶液:c(H+)>c(HCO3﹣)=2c(CO32﹣) |
| D.含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)] |
室温下,0.01 mol/L 二元酸H2A溶液的pH= 3,下列说法正确的是
A.在Na2A,NaHA两种溶液中,离子种类相同
B.NaHA溶液的pH一定大于7
C.在NaHA溶液中一定有c(OH-)+ c(A2-) = c(H2A)+ c(H+)
D.在溶质的物质的量相等的Na2A,NaHA两种溶液中,阴离子总数相等
25℃时。有c(CH3COOH)+ c(CH3COO-)=0.1mol/L的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-) 与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述中正确的是。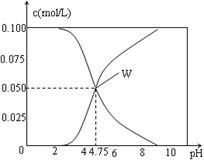
| A.pH=5.5的溶液中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.W点所表示的溶液中c(Na+) + c(H+)=c(CH3COO-)+c(OH-) |
| C.pH=3.5的溶液中:c(Na+) + c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L |
| D.向W点所表示的1L溶液中通入0.05molHCl气体(溶液的体积变化可忽略):c(H+)=c(OH-)+c(CH3COOH) |
下列溶液中有关微粒的物质的量浓度关系正确的是
| A.3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) |
| C.常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7 mol·L-1 |
| D.物质的量浓度之比为1∶2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
18.下列各溶液中,相关微粒物质的量浓度关系不正确的是
| A.0.1 mol·L-1NH3•H2O溶液中: c (NH4+)<c (OH-) |
| B.常温时,将等体积的盐酸和氨水混合后pH=7,则c(NH4+)=c(Cl-) |
| C.0.1 mol·L-1Na2CO3溶液中:c(HCO3-)+c(CO3-)+c(H2CO3)="0.1" mol·L-1 |
| D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4、NH4HSO4溶液,c(NH4+)大小顺序:CH3COONH4 >NH4Cl>NH4HSO4 |
25℃时,弱酸的电离平衡常数如下表,下列表述错误的是
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| K |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.CN-+H2O+CO2→HCN+HCO3-
B.相同温度时三种溶液的pH关系:Na2CO3> NaCN > CH3COONa
C.等体积、等物质的量浓度的CH3COOH和Na2CO3反应后的溶液呈碱性
D.amol/L HCN与bmol/L NaOH等体积混合溶液c(Na+)>c(CN-),则a一定小于b
常温下,向20.00mL 0.1000 mol (NH4)2 SO4溶液中逐滴加入0.2000 mol
(NH4)2 SO4溶液中逐滴加入0.2000 mol NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
下列说法正确的是
| A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C.点c所示溶液中:c(SO42)+ c(H+)= c(NH3·H2O )+ c(OH-) |
| D.点d所示溶液中:c(SO42)>c(NH3·H2O )>c(OH-)>c(NH4+) |
常温下,在25mL 0.1 mol·L-1 NaOH溶液中逐滴加入a mL 0.2 mol·L-1 CH3COOH溶液,有关混合溶液的判断正确的是
| A.当pH=7时,一定有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| B.当a=25时,一定有:c(CH3COO-)+c(CH3COOH)=c(Na+) |
| C.当c(CH3COO-)>c(Na+)时,a一定大于12.5 |
| D.当c(OH-)>c(H+)时,a一定小于12.5 |
下列叙述正确的是
| A.0.1mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 |
| C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等 |
D.在NaHCO3溶液中:c(OH-)+c(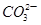 )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
下列说法正确的是
| A.0.1 mol/L溶液中的(NH4)2SO4,溶液中的c(NH4+)<c(SO42-) |
| B.相同温度下,0.6 mol/L氨水溶液与0.3 mol/l氨水溶液中c(OH-)之比是2:1 |
| C.向0.1 mol/LNaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D.向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)<c(CH3COO-) |
Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n( ): n(
): n( )变化的关系如下表:
)变化的关系如下表:
n( ): n( ): n( ) ) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+) < c (OH-)
B.Na2SO3溶液中c(Na+)> c ( )> c (
)> c ( ) > c (OH-) > c(H+)
) > c (OH-) > c(H+)
C.当吸收液呈中性时,c(Na+) >c ( ) > c (
) > c ( ) > c (OH-) = c(H+)
) > c (OH-) = c(H+)
D.当吸收液呈中性时,c(Na+)>c ( )+c (
)+c ( )
)
有0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |