[上海]2014届上海市崇明县高三上学期期末(一模)考试化学试卷
化学与社会、生产、生活密切相关。下列做法值得提倡的是
| A.SO2作为食品漂白剂 | B.氟里昂作为制冷剂 |
| C.Na2CO3治疗胃酸过多 | D.“地沟油”制取肥皂 |
重水 是重要的核工业原料,下列关于D原子的说法错误的是
是重要的核工业原料,下列关于D原子的说法错误的是
A.氘 原子核外有1个电子 原子核外有1个电子 |
B.是H的同位素 |
| C.自然界中没有D原子存在 | D. 质量数为2 质量数为2 |
下列叙述中,正确的是
| A.只含有金属元素的离子不一定是阳离子 |
| B.金属阳离子被还原不一定得到金属单质 |
| C.氧化还原反应中,非金属单质必是氧化剂 |
| D.元素从化合态变为游离态时,一定被还原 |
一定温度下,满足下列条件的溶液一定呈酸性的是
A.pH 的某物质的水溶液 的某物质的水溶液 |
B.加酚酞后显无色的溶液 |
| C.能与金属Al反应放出H2的溶液 | D. 的任意物质的水溶液 的任意物质的水溶液 |
下列化学工业中,未涉及原料循环使用的是
| A.侯德榜制碱法 | B.索尔维制碱法 |
| C.工业电解饱和食盐水 | D.工业炼铁 |
下列关于实验操作的叙述正确的是
| A.酸碱滴定时,眼睛一定要注视滴定管中液面的变化 |
| B.实验室制乙烯时,为使受热均匀,应轻轻搅动温度计 |
| C.纸上层析实验中,须将滤纸上的试样点浸入展开剂中 |
| D.分液时,下层液体先从分液漏斗下口放出,上层液体后从上口倒出 |
已知 。下列说法或表达正确的是
。下列说法或表达正确的是
| A.使用催化剂可改变该反应的反应热 |
B. ; ; |
C.A和 混合气体的稳定性比C气体强 混合气体的稳定性比C气体强 |
| D.该条件下,2LC气体分解成2LA气体与1LB气体吸收的热量为Q |
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种:
下列说法正确的是
A. 属于芳香烃 属于芳香烃 |
B. 与BHT互为同系物 与BHT互为同系物 |
| C.BHT久置于空气中不会被氧化 |
| D.两种方法的反应类型都是加成反应 |
如图用石墨电极电解CuCl2溶液。下列分析正确的是( )
| A.a极发生还原反应 |
| B.每生成6.4 g Cu,转移电子0.2 mol |
C.阳极反应式: |
| D.在直流电源中电流从b流向a |
用下列装置不能达到实验目的的是
| A.用甲图装置比较NaHCO3和Na2CO3的热稳定性 |
B.用乙图装置制备 |
| C.用丙图装置制备并收集少量NO2气体 |
| D.用丁图装置制取少量金属锰 |
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g) 2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
A.当容器内密度保持不变时,可以判断反应已达平衡
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
下列实验中,依据实验操作及现象,得出的结论正确的是
| |
操作 |
现 象 |
结 论 |
| A. |
测定等浓度的Na2CO3和Na2SO3 溶液的pH |
前者pH比后者的大 |
非金属性: |
| B. |
无色溶液中滴加氯水和CCl4, 振荡、静置 |
下层溶液显紫色 |
原溶液中有 |
| C. |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有 或  |
| D. |
向某无色溶液中滴加硝酸酸化的BaCl2溶液 |
产生白色沉淀 |
溶液中一定含有 |
恒温下使某盐溶液蒸发掉ag水,有bg不含结晶水的晶体析出,再蒸发掉ag水后,又有cg不含结晶水的晶体析出,则原溶液中溶质的质量分数为
A. |
B. |
C. |
D.无法确定 |
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为 g。下列说法不正确的是
g。下列说法不正确的是
A.镁铝合金与盐酸反应转移电子总数为 |
B. |
C.沉淀是 和 和 的混合物 的混合物 |
| D.1.2>a>0.9 |
设NA为阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,22.4 L甲苯中含 键数目为8 NA 键数目为8 NA |
| B.常温常压下,7.8 g苯中含有双键的数目为0.3 NA |
| C.苯和苯甲酸的混合物1 mol,完全燃烧消耗O2的分子数为7.5 NA |
| D.常温常压下,5.2 g苯和苯乙烯的混合物中含有原子数目为0.8 NA |
下列实验过程中产生的现象与所给图形相符合的是( )
| A.往乙酸中通入氨气 |
B.往 溶液中滴加硫酸 溶液中滴加硫酸 |
| C.往氢硫酸溶液中通入氯气 |
| D.往NaOH溶液中通入过量CO2 |
下列除杂分离方法正确的是
| 选项 |
物质 |
杂质 |
所用试剂 |
分离方法 |
| A. |
KCl |
CaCl2 |
Na2CO3溶液、盐酸 |
过滤 |
| B. |
CH3CH2OH |
CH3COOH |
CaO |
蒸馏 |
| C. |
NaCl |
NH4Cl |
NaOH |
蒸干 |
| D. |
N2 |
O2 |
铜网 |
加热 |
常温下,向20.00mL 0.1000 mol (NH4)2 SO4溶液中逐滴加入0.2000 mol
(NH4)2 SO4溶液中逐滴加入0.2000 mol NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
下列说法正确的是
| A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C.点c所示溶液中:c(SO42)+ c(H+)= c(NH3·H2O )+ c(OH-) |
| D.点d所示溶液中:c(SO42)>c(NH3·H2O )>c(OH-)>c(NH4+) |
0.02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为 和
和 ,同
,同
时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
| A.30 | B.46 | C.50 | D.66 |
自然界中的水要经过消毒杀菌才可成为生活饮用水。ClO2是一种高效安全灭菌消毒剂,
其中Cl化合价为 价。
价。
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 。
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价 B.气态氢化物的稳定性
C.元素在周期表中的位置 D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl B.稳定性:HF>HCl
C.酸性:HF>HCl D.沸点:HF>HCl
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3 O2 +[O]-Q 平衡常数为K1 ;
O2 +[O]-Q 平衡常数为K1 ;
反应② [O]+O3 2O2+Q 平衡常数为K2 ;
2O2+Q 平衡常数为K2 ;
总反应:2O3 3O2+Q 平衡常数为K。
3O2+Q 平衡常数为K。
(4)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
| pH t / min T / ℃ |
3.0 |
4.0 |
5.0 |
6.0 |
| 20 |
301 |
231 |
169 |
58 |
| 30 |
158 |
108 |
48 |
15 |
| 50 |
31 |
26 |
15 |
7 |
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(5)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A.40°C、pH=3.0 B.10°C、pH=4.0 C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大 B.K=K1+K2
C.适当升温,可提高消毒效率 D.压强增大,K2减小
部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HClO |
H2CO3 |
H2SO3 |
| 电离平衡常数 (25℃) |
 |
 |
 |
 |
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A.2ClO- + H2O + CO2 → 2HClO + CO32-
B.2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C.H2SO3 + 2HCOO- → 2HCOOH + SO32-
D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是…………………………………( )
A.H2O2既是氧化剂又是还原剂
B.H2O 既不是氧化产物又不是还原产物
C.H2SeO4既是氧化产物又是还原产物
D.氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸, ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
HI+ H6TeO6 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O
(6)若反应中生成的TeO2与Te的物质的量之比为 ,试配平上述化学方程式。
,试配平上述化学方程式。
某兴趣小组设计并进行了以下实验来探究Cl2、漂白粉的制备及有关性质。
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:
H→ 、 → 、 → ;广口瓶Ⅱ中的试剂为 。
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:
;
某学生设计如下实验进一步探究SO2与漂粉精的反应:
| 操作 |
现象 |
| 取4 g漂粉精固体,加入100 mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
 A |
ⅰ.液面上方出现雾状物 ⅱ.稍后,出现浑浊,溶液变为黄绿色 ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(3)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(4)该同学推测现象i的雾状物由盐酸小液滴形成,进行如下实验加以进一步验证:
a.用湿润的碘化钾淀粉试纸检验雾状物,无变化;
b.搜集雾状物,用酸化的AgNO3溶液检验,产生白色沉淀。
实验a的目的是 。
(5)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的某些成份之间发生反应。请设计实验方案,进一步确认这种可能性,方案为
。
(6)用化学方程式解释现象ⅲ中黄绿色褪去的原因: 。检验褪色后溶液中是否有 的方法是: 。
的方法是: 。
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下: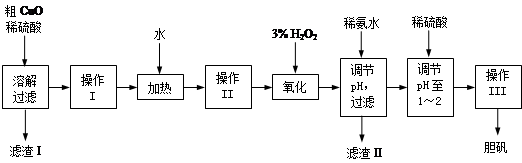
经操作I得到粗胆矾,操作III得到精制胆矾。两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
已知: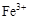 、
、 、
、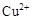 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| |
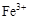 |
 |
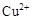 |
| 开始沉淀时的pH |
2.7 |
7.6 |
5.2 |
| 完全沉淀时的pH |
3.7 |
9.6 |
6.4 |
(1)溶解、过滤需要用到玻璃棒,它的作用是 。
(2)写出加入3% H2O2后发生反应的离子方程式 。(原溶液显酸性)。
(3)加稀氨水调节pH应调至范围 。下列物质可用来替代稀氨水的是 。(填字母)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3
(4)操作III析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、________________。
(5)某学生用操作III所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如下表所示:
| |
第一次实验 |
第二次实验 |
| 坩埚质量(g) |
14.520 |
14.670 |
坩埚质量 晶体质量(g) 晶体质量(g) |
17.020 |
18.350 |
| 第一次加热、冷却、称量(g) |
16.070 |
16.989 |
| 第二次加热、冷却、称量(g) |
16.070 |
16.988 |
两次都无须再做第三次加热、冷却、称量,理由是 ,该生此次实验的相对误差为 %(保留1位小数),产生实验误差的原因可能是
(填字母)。
A.加热前称量时坩埚未完全干燥 B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却 D.玻璃棒上沾有的固体未刮入坩埚
丁子香酚结构简式为 ,有机物F是丁子香酚的一种同分异构体,是有机化工原
,有机物F是丁子香酚的一种同分异构体,是有机化工原
料,用于合成药物的中间体。
某校兴趣小组设计以下方案合成F:
试回答下列问题:
(1)下列物质不能与丁子香酚反应的是 (填字母)。
A.NaOH B.NaHCO3 C.Br2 D.C2H5OH
(2)关于A→B的反应类型可能是 (填字母)。
A.加成反应 B.取代反应 C.聚合反应 D.消除反应
(3)写出D→E反应的化学方程式 。
(4)满足下列条件的E的同分异构体有 种。
①含有苯环,且苯环上只有两个取代基
②能发生银镜反应
③能与氢氧化钠反应
(5)由C经过一步反应可制得一种烈性炸药,写出该反应的化学方程式: 。
卤代烃(R-X)在醚类溶剂中与Mg反应可制得格氏试剂,格氏试剂在有机合成方面用途广泛。
已知:
(R表示烃基,R′和R″表示烃基或氢)
某有机物A有如下转化:
试回答下列问题:
(1)B→A的反应条件为__________________________,B→C的反应类型是_______________。
(2)G的结构简式是_______________________________。
(3)H中所含官能团的名称是________________________________________。
(4)写出一种满足下列条件的物质H的同分异构体的结构简式 ____________________________
①能发生银镜反应;②有三种不同氢原子;③含有最多的甲基
(5)聚苯乙烯(PS)由苯乙烯( )聚合而成,是一种多功能塑料,广泛应用于食品包装,机器设备等许多日常生活领域中。写出以 D和苯为主要原料制备苯乙烯(
)聚合而成,是一种多功能塑料,广泛应用于食品包装,机器设备等许多日常生活领域中。写出以 D和苯为主要原料制备苯乙烯( )的合成路线流程图,无机试剂任选。
)的合成路线流程图,无机试剂任选。
(合成路线常用表示方法为:A B ……
B …… 目标产物)
目标产物)
天然碱的组成可以用 (a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
(a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
将质量为31.0 g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 2.24 L(标准状况)和水5.4 g。
(1)天然碱A的化学式中:


已知:Na2CO3与稀盐酸的反应分下列两步进行:
Na2CO3+HCl NaCl+NaHCO3 NaHCO3+HCl
NaCl+NaHCO3 NaHCO3+HCl NaCl+CO2↑+H2O
NaCl+CO2↑+H2O
将质量为12.45 g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐
酸的体积(标准状况)的关系如下表所示:
| 盐酸体积(mL) |
20 |
40 |
60 |
80 |
| 产生气体体积(mL) |
0 |
560 |
1680 |
2520 |
(2)由表中数据可推测加入50mL盐酸时,产生气体的体积为 mL(标准状况);盐酸的浓度为 mol/L;天然碱B的化学式为: 。
(3)若取一定质量的天然碱B加入到30mL该浓度的盐酸中,请写出产生气体体积V(mL,标准状况)与天然碱B质量W(g) 之间的关系式。
 乙
乙 丁,其中丁为强酸,则甲不可能为
丁,其中丁为强酸,则甲不可能为 粤公网安备 44130202000953号
粤公网安备 44130202000953号