实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+(滴定时,1 mol(CH2)6N4H+与 l mol H+相当),然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤II:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④判断滴定终点的现象是 。
⑤如图是某次滴定时的滴定管中的液面,其读数为 mL。
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1050mol·L-1则该样品中氮的质量分数为 。
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL 烧碱溶液于锥形瓶中,并加几滴酚酞指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
(1)正确的操作步骤是(填写字母): → → →D→ 。
(2)操作D中液面应调整到 ;开始E操作前须确保尖嘴部分 。
(3)以下操作会造成所测烧碱溶液浓度偏低的是 。
A.酸式滴定管未用待装溶液润洗
B.碱式滴定管未用待装溶液润洗
C.锥形瓶未用待装溶液润洗
D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.在滴定前仰视,滴定后平视
F.滴定结束还有一滴挂在滴定管尖嘴外面
(4)该烧碱样品的纯度计算式是 (需化简)。
中和滴定是化学定量实验之一。某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是__________________。(写序号)
(2)选用的指示剂是 。(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。
| 滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000 mol/L 盐酸的体积/ mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
| 第一次 |
25.00 |
|
|
|
| 第二次 |
25.00 |
2.00 |
28.08 |
26.08 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(7)滴定终点的判定依据是 。
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6(相对分子质量为176),人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸。维生素C易被空气中的氧气氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中维生素C的含量在500 mg·L-1左右。校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量。下面是测定实验分析报告,请填写有关空白。
(1)测定目的:测定××牌软包装橙汁维生素C含量。
(2)测定原理:C6H8O6+I2  C6H6O6+2H++2I-。
C6H6O6+2H++2I-。
(3)实验用品及试剂:
①仪器和用品(自选,略)。
②试剂:指示剂 (填名称)、浓度为7.50×10-3mol·L-1标准碘溶液、蒸馏水等。
(4)实验过程:
①洗涤仪器:检查滴定管是否漏液,润洗后装好标准碘溶液待用。
②打开橙汁包装,目测:颜色——橙黄色,澄清度——好。用 (填仪器名称)向锥形瓶中移入25.00 mL待测橙汁,滴入2滴指示剂。
③用左手控制滴定管的 (填部位的名称),右手摇动锥形瓶,眼睛注视 直到滴定终点。滴定至终点的现象是 。
(5)数据记录与处理。滴定中消耗标准碘溶液的体积见下表,请计算此橙汁中维生素C的含量是② mg·L-1。

(12分)实验室利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4 + 6HCHO = 3H+ + 6H2O + (CH2)6N4H+
+ 6HCHO = 3H+ + 6H2O + (CH2)6N4H+
然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行如下实验:
[滴定时,1 mol (CH2)6N4H+与1 mol H+ 相当]
步骤Ⅰ:称取样品1.500 g
步骤Ⅱ:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀
步骤Ⅲ:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次
步骤Ⅳ:实验数据记录
<若NaOH标准溶液的浓度为0.1010 mol/L>
| 滴定次数 |
待测液的体积(mL) |
标准溶液的体积 |
|
| 滴定前刻度(mL) |
滴定后刻度(mL) |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
根据上述实验步骤填空:
(1)滴定操作时,眼睛应观察
(2)滴定终点的判断方法是
(3)锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)
(4)碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分
数 (填“偏大”、“偏小”或“无影响”)
(5)配制样品溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、滴定管外,
还有 (填仪器名称)
(6)该样品中氮的质量分数为
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。
(1)滴定时应选用 作指示剂;
(2)判断到达滴定终点的实验现象是 。
(3)下列操作会导致烧碱样品中NaOH含量测定值偏高的是
| A.锥形瓶用蒸馏水洗后未用待测液润洗 |
| B.酸式滴定管用蒸馏水洗后未用标准液润洗 |
| C.在滴定前有气泡,滴定后气泡消失 |
| D.滴定前平视读数,滴定结束俯视读数 |
(4)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·L-1的盐酸标准液进行滴定,相关数据记录如下:
| 实验编号 |
V(烧碱溶液)/mL |
V(HCl)/mL |
|
| 初读数 |
末读数 |
||
| 1 |
20.00 |
0.80 |
21.00 |
| 2 |
20.00 |
1.00 |
20.80 |
| 3 |
20.00 |
0.20 |
22.80 |
依据表中数据,计算出烧碱样品中含NaOH的质量分数为 %。(小数点后保留两位数字)
(5)若某样品可能由NaOH、Na2CO3、NaHCO3中的一种或两种组成,为确定其组成,某同学进行下列实验:
准确称取mg样品配制成250mL溶液,取配制好的溶液20.00mL于锥形瓶中,加入2滴酚酞作指示剂,用浓度为cmol·L-1的盐酸标准液进行滴定至终点,消耗盐酸标准液v1ml,然后再滴加2滴甲基橙继续用浓度为cmol·L-1的盐酸标准液进行滴定至终点,消耗盐酸标准液v2ml(v1和v2均不为0),
根据v1和v2数值大小判断样品的组成(用化学式表示):
①v1>v2
②v1=v2
③v1<v2
滴定实验是中学常用的定量实验,主要原理是利用已知浓度的某溶液滴加到未知浓度的溶液中,通过恰好完全反应的“终点”的判断,实验测出消耗的两种物质的量来计算未知浓度的溶液的浓度。
下面是甲同学用滴定实验来测定食用精制盐中的碘含量(食盐中加入一定量的KIO3)。
已知:I2+2S2O32-=2 I-+S4O62-,其步骤为:
A.准确称取w g食盐,加适量蒸馏水使其完全溶解;
B.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
C.以淀粉为指示剂,逐滴加入物质的量浓度为2.000×10-3 mol/L的Na2S2O3溶液15.00 mL,恰好反应完全。
(1)配平化学方程式 KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)判断c中反应恰好完全依据的现象是:当滴加最后一滴Na2S2O3溶液后,溶液由 色变为 色,且颜色半分钟内不改变 。
(3)根据以上实验,所测精制食盐中的碘含量是 mg/kg。(以含w的代数式表示)
(4)已知在酸性环境下:2H+ + S2O32- =" S↓" + SO2 ↑+ H2O,所以乙同学认为在c操作前应 ,否则实验测得食盐中碘的含量会 (填“偏高”或“偏低”或“没有影响”)
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中溶液的颜色从_________色变为___________色时,停止滴定。
(2)下图中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是_________,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是___________(填“偏高”、“偏低”或“无影响”)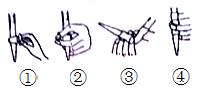
(3)图中是某次滴定时的滴定管中的液面,其读数为__________mL。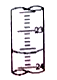
(4)根据下列数据:
| 滴定次数 |
待测液体积 |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.20 |
24.10 |
| 第二次 |
20.00 |
3.00 |
27.10 |
请计算待测烧碱溶液的浓度为____________mol/L。
草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定管在使用之前,必须进行的操作是 ,滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点时的现象为 .
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,C处的刻度为20,滴定管中液面读数应为 mL,此时滴定管中液体的体积 30.60 mL.(填大于、小于或等于)

(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗KMnO4溶液体积/mL |
22.32 |
24.39 |
24.41 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显少于后两次,其原因可能是_
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过后,未用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出H2C2O4的物质的量浓度的表达式(必须化简):C=
(5)请你一个设计简单实验证明草酸的酸性强于碳酸,实验操作及现象是
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上操作步骤中有一步有错误,请指出编号 ,该错误操作会导
致测定结果 (填“偏大”、“偏小”或“无影响”)
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 中。(从右图中选填“甲”或“乙”)

(3)下列操作会引起实验结果偏大的是: (填编号)
| A.在锥形瓶装液前,留有少量蒸馏水 |
| B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡 |
| C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗 |
| D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外 |
(4)判断到达滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟之内不再改变。
(5)以下是实验数据记录表

通过计算可得,该盐酸浓度为: mol·L-1(计算结果保留2位小数)。
醋酸是日常生活中常见的弱酸。
I.常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是 mol·L-1。
II.某同学用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL某浓度的CH3COOH溶液
(1)部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述操作过程中存在错误的序号_________________。上述实验与一定物质的量浓度溶液配制实验中用到的相同仪器__________________。
(2)某次滴定前滴定管液面如图所示,读数为________mL。


(3)根据正确实验结果所绘制的滴定曲线如上图所示,其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。计算醋酸的电离常数___________,该CH3COOH的物质的量浓度为__________ mol•L—1。
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
Ⅰ.称量4.910g三草酸合铁酸钾晶体,配制成250mL溶液。
Ⅱ.取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,滴加KMnO4溶液至草酸根(C2O42−)恰好全部氧化成二氧化碳,同时MnO4−被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至溶液的黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
Ⅲ.用0.01000mol/L KMnO4溶液滴定步骤Ⅱ所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4−被还原成Mn2+ 。
Ⅳ.重复步骤Ⅱ、步骤Ⅲ操作,滴定消耗0.01000mol/L KMnO4溶液19.98mL
请回答下列问题:
(1)滴定过程中需添加的指示剂是(若不需要请说明理由)
(2)加入锌粉的目的是 。
(3)写出步骤Ⅲ中发生反应的离子方程式 。
(4)实验测得该晶体中铁的质量分数为 ;X= 。
(5)在步骤Ⅱ中,若加入的KMnO4的溶液的量不够,则测得的铁含量 ;(选填“偏低”“偏高”“不变”,下同)若加入的锌粉的量不够,则测的铁的含量 。
某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要___________。
(2)滴定:
Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上。
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”刻度线以下,并记录读数。
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液。
Ⅳ.用标准液滴定至终点,记录滴定管液面读数。
①上述滴定步骤中有错误的是(填编号)____________。该错误操作会导致测定结果___________(填“偏大”、“偏小”或“无影响”)。
②排去碱式滴定管中气泡的方法应采用右图的___________操作。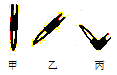
③步骤Ⅳ中滴定时眼睛应____________;判断滴定终点的现象是_____________。
④若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果___________(填“偏大”、“偏小”或“无影响”)
(3)按正确操作测得有关数据记录如下:按正确操作测得有关数据记录如下:
| 滴定次数 |
待测液体积 |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.20 |
20.38 |
| 第二次 |
20.00 |
4.00 |
24.20 |
| 第三次 |
20.00 |
2.38 |
a |
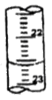
①a的读数如图所示,则a=___________;②烧碱样品的纯度为_________ %
氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1 KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO4﹣+5HSO3﹣+H+===2Mn2++5SO42﹣+3H2O填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
| A.酸式滴定管(50 mL) |
| B.碱式滴定管(50 mL) |
| C.量筒(10mL) |
| D.锥形瓶 |
E.铁架台
F.滴定管夹
G.烧杯
H.白纸
I.胶头滴管
J.漏斗
(2)不能用______(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因_______________。
(3)指示剂 _______ (填“需要”或“不需要”)选用,说明理由_______________________________。
(4)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为:__________________________(用离子方程式表示)。
(2)滴定时,KMnO4溶液应装在 (填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为 。
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为____ mL。

(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗KMnO4溶液体积/mL |
26.32 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C= mol/L。