河北省唐山市高二上学期期末考试化学试卷
下列反应一定能自发进行的是( )
| A.放热反应 | B.熵增加的反应 | C.熵增加的吸热反应 | D.熵增加的放热反应 |
室温下,某溶液由水电离出来的c(OH-)=10-13mol/L,则该溶液的溶质不可能是( )
| A.HCl | B.NaOH | C.H2SO4 | D.NH4NO3 |
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O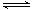 HCOO-+H3O+ HCOO-+H3O+ |
B.HS-+H2O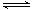 S2-+H3O+ S2-+H3O+ |
C.CO32-+H2O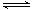 HCO3-+OH- HCO3-+OH- |
D.HCO3-+H2O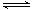 CO32-+H3O+ CO32-+H3O+ |
体积恒定的密闭容器中,反应2SO2(g)+O2(g)  2SO3(g) △H<0,达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正向移动的是( )
2SO3(g) △H<0,达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正向移动的是( )
| A.移去SO3 | B.加入催化剂 | C.通入O2 | D.降低温度 |
下列电离方程式中书写正确的是( )
A.NaHSO4 Na++H++SO42- Na++H++SO42- |
B.NaHCO3 Na++H++CO32- Na++H++CO32- |
| C.HClO=H++ClO- | D.H2S H++HS- H++HS- |
常温下,物质的量浓度相同的下列溶液,NH4+浓度最大的是( )
| A.NH4Cl | B.NH4HCO3 | C.NH4HSO4 | D.CH3COONH4 |
在平衡2CrO42-(黄色)+2H+ Cr2O32-(橙红色)+H2O中,溶液介于黄色和橙红色之间,欲使溶液的橙红色加深,则要在溶液中加入( )
Cr2O32-(橙红色)+H2O中,溶液介于黄色和橙红色之间,欲使溶液的橙红色加深,则要在溶液中加入( )
| A.H+ | B.OH- | C.K+ | D.H2O |
体积相同,pH也相同的盐酸和醋酸分别与足量的碳酸钠反应,产生的CO2气体的体积( )
| A.盐酸多 | B.醋酸多 | C.一样多 | D.无法确定 |
将纯水加热至较高温度,下列叙述正确的是( )
| A.水的离子积变大,c(H+)变大,呈中性 |
| B.水的离子积不变,c(H+)不变,呈中性 |
| C.水的离子积变小,c(H+)变小,呈碱性 |
| D.水的离子积变大,c(H+)变大,呈酸性 |
在一定温度下,可逆反应A(g)+3B(g)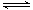 2C(g)达到平衡状态的标志是( )
2C(g)达到平衡状态的标志是( )
A.A、B、C的浓度相等
B.C的生成速率与C的分解速率相等
C.A、B、C的分子数目之比为1:3:2
D.单位时间内,生成1molA,同时生成3molB
在下列各说法中正确的是( )
| A.酸碱中和时放出的热叫做中和热 |
| B.△H>0表示放热反应,△H<0表示吸热反应 |
| C.1molH2与0.5molO2反应放出的热就是H2的燃烧热 |
| D.热化学方程式中的化学计量数表示物质的量,可以是分数 |
对已经达到化学平衡状态的下列反应2X(g)+Y2(g) Z(g),减小压强时,对反应产生的影响是( )
Z(g),减小压强时,对反应产生的影响是( )
| A.v正、v逆都减小,平衡逆向移动 | B.v正、v逆都增大,平衡正向移动 |
| C.v逆增大,v正减小,平衡逆向移动 | D.v逆减小,v正增大,平衡正向移动 |
反应PCl5(g) PCl3(g)+Cl2(g) ① 2HI(g)
PCl3(g)+Cl2(g) ① 2HI(g) H2(g)+I2(g) ②。在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
H2(g)+I2(g) ②。在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
| A.均增大 | B.均不变 |
| C.①增大,②不变 | D.①减小,②不变 |
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为( )
| A.920kJ | B.557kJ | C.436kJ | D.188kJ |
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是( )

| A.Ⅱ为盐酸稀释时的pH变化曲线 |
| B.a点Kw的数值比c点Kw的数值大 |
| C.b点酸的总浓度小于a点酸的总浓度 |
| D.b点溶液的导电性比c点溶液的导电性强 |
饱和石灰水中存在溶解平衡:Ca(OH)2(s)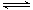 Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
| A.溶液的pH不变 | B.溶液中Ca2+的浓度减小 |
| C.溶液中OH-的数目减小 | D.容器中固体的质量增加 |
在其他条件不变时,下列说法正确的是( )
| A.增大压强一定会破坏气体反应的平衡状态 |
| B.升高温度可使化学平衡向放热的方向移动 |
| C.使用催化剂只能改变反应速率,不能改变化学平衡状态 |
| D.增大反应物浓度或减小生成物浓度,平衡向逆反应方向移动 |
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
| A.相同浓度的两种溶液中c(H+)相同 |
| B.均为100mL0.1mol/L的两种溶液可中和等物质的量的氢氧化钠 |
| C.pH=3的两种溶液稀释100倍,pH都为5 |
| D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 |
对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是( )
2C(g) △H<0,下列各图中正确的是( )
A.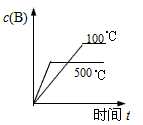 |
B.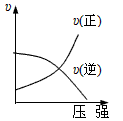 |
C.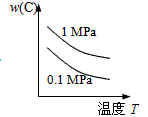 |
D.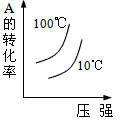 |
下列事实不能用勒夏特列原理来解释的是( )
| A.加压有利于SO2与O2反应生成SO3 |
| B.用过量氮气与氢气反应可以提高氢气的转化率 |
| C.将混合气中的氨气液化分离,有利于合成氨的反应 |
D.密闭容器中发生反应H2(g)+I2(g) 2HI (g),增大压强时容器中颜色加深 2HI (g),增大压强时容器中颜色加深 |
某溶液中含有KCl、KBr、K2CrO4,浓度均为0.01mol/L,已知Ksp(AgCl)=1.77×10-10,Ksp(AgBr)=5.35×10-13,Ksp(Ag2CrO4)=1.12×10-12,向溶液中逐滴加入0.01mol/LAgNO3溶液时,最先产生沉淀的是( )
| A.AgCl | B.AgBr | C.Ag2CrO4 | D.同时沉淀 |
用酸性氢氧燃料电池为电源电解CuSO4溶液的实验装置如下图所示。下列说法中正确的是( )
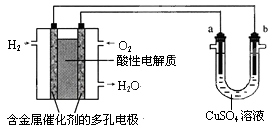
| A.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH- |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
下图为教材中测定中和热的简易量热计。
(1)图中尚缺少的玻璃仪器是_____________,实验中若用金属质地的仪器来代替会使得的△H___(填“偏高”、“偏低”或“无影响”)。
(2)如果用50mL0.50mol/L的盐酸和50mL0.55mol/L的氢氧化钠溶液进行实验,已知二者的密度均为1g/cm3,比热容c=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃,则中和热△H为______kJ/mol,实验中氢氧化钠溶液比盐酸浓度大的原因是____________________。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中溶液的颜色从_________色变为___________色时,停止滴定。
(2)下图中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是_________,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是___________(填“偏高”、“偏低”或“无影响”)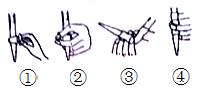
(3)图中是某次滴定时的滴定管中的液面,其读数为__________mL。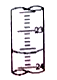
(4)根据下列数据:
| 滴定次数 |
待测液体积 |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.20 |
24.10 |
| 第二次 |
20.00 |
3.00 |
27.10 |
请计算待测烧碱溶液的浓度为____________mol/L。
2SO2(g)+O2(g) 2SO3(g) △H=-198kJ/mol,反应过程的能量变化如图所示。
2SO3(g) △H=-198kJ/mol,反应过程的能量变化如图所示。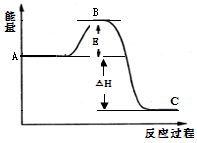
请回答下列问题:
(1)图中A表示__________,该反应加入V2O5作催化剂后E如何变化_______(填“升高”、“降低”或“不变”)。
(2)如果反应速率v(SO2)为0.05mol/(L·min),则v(O2)="_________" mol/(L·min)、v(SO3)=_____mol/(L·min)
(3)已知单质硫燃烧热的数值为296kJ/mol,则1molS(s)完全反应生成SO3(g)时放出的热量为________kJ。
(4)某人设想以如图所示装置用电化学原理生产硫酸,通入O2的一极为_______________(填写“正”或“负”)极;写出通入SO2一极的电极反应____________________。
在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为_________反应(选填“吸热”、“放热”)。
(2)能判断该反应是否达到化学平衡状态的依据是______________。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______℃。
(4)1200℃时,某体系中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的方向为____________。(选填“正向”“逆向”或“不移动”)。
(1)在25℃条件下将pH=10的氨水稀释10倍后溶液的pH为(填序号)________。
A.9 B.11 C.9~10之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,溶液pH_________(填“增大”、“减小”或“不变”),主要原因是________________。
(3)已知某溶液中只存在NH4+、H+、OH-、Cl-四种离子,该溶液中各离子浓度大小顺序可能有如下几种关系:
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
①上述离子浓度大小关系不可能的是_________(填序号)。
②若溶液中只溶解了一种溶质,则该溶质是____________,上述离子浓度大小顺序关系中正确的是(选填序号)________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) ________ c(NH3·H2O)(填>、<或=)
(4)25℃时,如果将0.1molNH4Cl和0.05molNaOH溶于水,形成混合溶液,(假设无气体逸出损失),则NH4+和NH3·H2O两种粒子的物质的量之和等于________mol。
 2NH3(g)。
2NH3(g)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号