氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1 KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO4﹣+5HSO3﹣+H+===2Mn2++5SO42﹣+3H2O填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
| A.酸式滴定管(50 mL) |
| B.碱式滴定管(50 mL) |
| C.量筒(10mL) |
| D.锥形瓶 |
E.铁架台
F.滴定管夹
G.烧杯
H.白纸
I.胶头滴管
J.漏斗
(2)不能用______(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因_______________。
(3)指示剂 _______ (填“需要”或“不需要”)选用,说明理由_______________________________。
(4)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
 有关反应的化学方程式为________________________________。
有关反应的化学方程式为________________________________。 _________________________________。
_________________________________。 的NaOH溶液50mL与0.50
的NaOH溶液50mL与0.50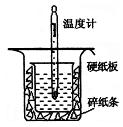
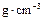 ,假定反应后生成溶液的比热容近似为水的比热容
,假定反应后生成溶液的比热容近似为水的比热容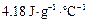 ,用t1℃和t2℃代表反应前后溶液的温度,则该实验中和热的计算表达式为
,用t1℃和t2℃代表反应前后溶液的温度,则该实验中和热的计算表达式为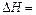 。
。


 2和NO,并验证其性质,装置图如下:
2和NO,并验证其性质,装置图如下:

 H溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2、KMnO4(H+)溶液、稀HNO3。
H溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2、KMnO4(H+)溶液、稀HNO3。 的作用是,操作方法是。
的作用是,操作方法是。 粤公网安备 44130202000953号
粤公网安备 44130202000953号