滴定实验是中学常用的定量实验,主要原理是利用已知浓度的某溶液滴加到未知浓度的溶液中,通过恰好完全反应的“终点”的判断,实验测出消耗的两种物质的量来计算未知浓度的溶液的浓度。
下面是甲同学用滴定实验来测定食用精制盐中的碘含量(食盐中加入一定量的KIO3)。
已知:I2+2S2O32-=2 I-+S4O62-,其步骤为:
A.准确称取w g食盐,加适量蒸馏水使其完全溶解;
B.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
C.以淀粉为指示剂,逐滴加入物质的量浓度为2.000×10-3 mol/L的Na2S2O3溶液15.00 mL,恰好反应完全。
(1)配平化学方程式 KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)判断c中反应恰好完全依据的现象是:当滴加最后一滴Na2S2O3溶液后,溶液由 色变为 色,且颜色半分钟内不改变 。
(3)根据以上实验,所测精制食盐中的碘含量是 mg/kg。(以含w的代数式表示)
(4)已知在酸性环境下:2H+ + S2O32- =" S↓" + SO2 ↑+ H2O,所以乙同学认为在c操作前应 ,否则实验测得食盐中碘的含量会 (填“偏高”或“偏低”或“没有影响”)
 KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )
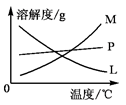
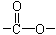 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
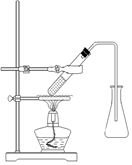
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为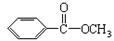 )是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(
)是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯。已知:
)]、甲醇为原料制备苯甲酸甲酯。已知:


 粤公网安备 44130202000953号
粤公网安备 44130202000953号