常温时,下列事实一定能证明HA是弱酸的是
| A.用HA溶液做导电实验,灯泡很暗 |
| B.HA和CaCO3发生反应放出CO2 |
| C.pH=2的HA溶液稀释至100倍,pH小于4 |
| D.pH=3的HA溶液中水电离出的c(H+)为10-11mol·L-1 |
下列溶液中c(Cl-)与50 mL 1mol/L 的AlCl3溶液中氯离子浓度相等的是
| A.150 mL 1mol/L NaCl溶液 | B.75 mL 2mol/L NH4Cl溶液 |
| C.75 mL 1mol/L FeCl3溶液 | D.150 mL 2mol/L MgCl2溶液 |
L-1 CH3COOH水溶液,⑤50 mL 0.20 mol·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是
| A.①>②>③>④>⑤ | B.②>①>③>④>⑤ |
| C.②>③>④>①>⑤ | D.⑤>④>③>②>① |
下列关于电解质溶液的叙述正确的是( )
| A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为: c(Cl-)>c(NH  )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
某溶液中由水电离出来的C(OH—)=10-12mol/L,则该溶液中的溶质不可能是( )
| A.HCl | B.NaOH | C.NH4Cl | D.H2SO4 |
在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
| A.11.52 | B.11.70 | C.11.82 | D.12.00 |
下列事实不能用勒夏特利原理来解释的是
| A.增大压强,有利于SO2和O2反应生成SO3 |
| B.热的纯碱溶液去油污能力较强 |
| C.加催化剂使N2和H2在一定条件下转化为NH3 |
| D.常温下pH=3的H2SO4溶液中水的电离程度小于pH=3的NH4Cl溶液中水的电离程度 |
右图是向100mL的盐酸中逐滴加入NaOH溶液时,混合溶液的pH变化图像,根据图像得出的结论正确的是
| A.原盐酸溶液的浓度为0.1mol/L |
| B.加入的NaOH溶液的浓度为0.1mol/L |
| C.至滴定终点用去NaOH为0.01mo1 |
| D.pH=12时,共加入NaOH溶液100mL |
量取25.00mL硫酸溶液,可选用的仪器是
| A.50mL量筒 | B.25mL量筒 |
| C.50mL碱式滴定管 | D.50mL酸式滴定管 |
在一定条件下,0.2 mol下列气体分别与1 L 0.2 mol.L一1的NaOH溶液反应,形成的溶液pH最小的是
| A.SO3 | B.SO2 | C.NO2 | D.CO2 |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

| A.a点由水电离出的c(H+)=1.0×10-14mol·L-1 |
| B.b点:c(NH)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
常温下,体积、物质的量浓度均相等的四种溶液:①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
| A.将①与②分别稀释相同倍数后溶液的pH:①>② |
| B.③与④中已电离的水分子的数目相等 |
| C.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3·H2O) |
| D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
V mL密度为ρ g·mL-1的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶
质的质量分数为w%,物质的量浓度为c mol·L-1,那么下列关系式正确的是( )
A.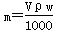 |
B.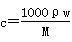 |
C.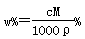 |
D.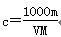 |