在KCl、FeCl3、Fe2(SO4)3三种盐配成的混合溶液中,若K+为0.15 mol,Fe3+为0.25 mol,Cl-为0.2 mol,则SO42-为
| A.0.1 mol | B.0.15 mol | C.0.25 mol | D.0.35 mol |
下列叙述正确的是
| A.氨水是强碱 | B.含金属元素的离子不一定是阳离子 |
| C.凡能电离出H+的化合物均属酸 | D.盐类物质一定含有金属阳离子 |
室温下取0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________ mol·L-1 c(H+)-c(MOH) =__________ mol·L -1
-1
(2)室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为_______________________。
某学生的实验报告所列出的下列数据中合理的是
| A.用10mL量筒量取7.13mL稀盐酸 |
| B.用托盘天平称量25.20g NaCl |
| C.用广泛pH试纸测得某溶液的pH为2.3 |
| D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL |
有人建议有AG来表示溶液的酸度,AG的定义为AG=lg[c(H+)/c(OH-)]。则下列表述正确的是( )
| A.在25℃时,若溶液呈中性,则pH=7,AG=1 |
| B.在25℃时,若溶液呈酸性,则pH〈7 AG〈0 |
| C.在25℃时,若溶液呈碱性,则pH〉7 AG〉0 |
| D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH) |
下列事实不能用勒夏特利原理来解释的是
| A.增大压强,有利于SO2和O2反应生成SO3 |
| B.热的纯碱溶液去油污能力较强 |
| C.加催化剂使N2和H2在一定条件下转化为NH3 |
| D.常温下pH=3的H2SO4溶液中水的电离程度小于pH=3的NH4Cl溶液中水的电离程度 |
右图是向100mL的盐酸中逐滴加入NaOH溶液时,混合溶液的pH变化图像,根据图像得出的结论正确的是
| A.原盐酸溶液的浓度为0.1mol/L |
| B.加入的NaOH溶液的浓度为0.1mol/L |
| C.至滴定终点用去NaOH为0.01mo1 |
| D.pH=12时,共加入NaOH溶液100mL |
量取25.00mL硫酸溶液,可选用的仪器是
| A.50mL量筒 | B.25mL量筒 |
| C.50mL碱式滴定管 | D.50mL酸式滴定管 |
在一定条件下,0.2 mol下列气体分别与1 L 0.2 mol.L一1的NaOH溶液反应,形成的溶液pH最小的是
| A.SO3 | B.SO2 | C.NO2 | D.CO2 |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

| A.a点由水电离出的c(H+)=1.0×10-14mol·L-1 |
| B.b点:c(NH)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
常温下,体积、物质的量浓度均相等的四种溶液:①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
| A.将①与②分别稀释相同倍数后溶液的pH:①>② |
| B.③与④中已电离的水分子的数目相等 |
| C.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3·H2O) |
| D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
V mL密度为ρ g·mL-1的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶
质的质量分数为w%,物质的量浓度为c mol·L-1,那么下列关系式正确的是( )
A.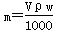 |
B.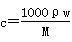 |
C.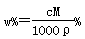 |
D.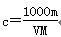 |