根据下表数据,比较在相同温度下,下列三种酸的相对强弱,正确的是:
| 酸 |
HX |
HY |
HZ |
||||
| 浓度mol•L-1 |
0.1 |
0.5 |
1 |
1 |
1 |
||
| 电离度a% |
0.3 |
0.15 |
0.1 |
0.3 |
1.0 |
||
A.HX>HY>HZ B.HZ>HX>HY C.HY>HZ>HX D.HZ>HY>HX
常温下,取pH="2" 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)="0.01mol" /L
C.pH=3的NaHA水溶液中,离子浓度大小为
c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为
c(Na+)>c(B2-)>c(OH-)>c(H+)
下列有关说法中正确的是( )
A.HCO3—水解:HCO3—+H2O  CO32—+H3O+ CO32—+H3O+ |
| B.中和滴定时眼睛必须注意锥形瓶内溶液颜色的变化 |
| C.电解水生成H2和O2的实验中,可加入少量盐酸或硫酸增强导电性 |
| D.用等浓度(0.5 mol·L-1)等体积(50 mL)的NaOH溶液与盐酸混合测定中和热 |
用0.10mol/L的NaOH溶液滴定100.0mL0.10mol/LHCl溶液时,滴定误差在±0.1%以内,反应完毕后溶液的pH变化范围是
| A.6.9~7.1 | B.4.3~9.7 | C.3.6~10.4 | D.以上都不正确 |
下图是向100mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图像。根据图像所得结论正确的是( )
| A.原来盐酸的物质的量浓度为1mol·L-1 |
| B.X为0.1mol·L-1的NaOH溶液 |
| C.原来盐酸的物质的量浓度为0.1mol·L-1 |
| D.X为0.01mol·L-1的NaOH溶液 |
常温下,pH=11的NaOH溶液aL分别与下列3种溶液混合,充分反应后使溶液呈中性:
①pH=3的醋酸bL;②物质的量浓度为1×10-3 mol/L的醋酸c L;③ c(OH-)=1×10-11 mol/L的H2SO4的溶液d L。判断a、b、c、d的大小关系,正确的是
|
常温时,将pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为:
| A.1:9 | B.9:1 | C.10:1 | D.1:10 |
下列事实不能用勒夏特利原理来解释的是
| A.增大压强,有利于SO2和O2反应生成SO3 |
| B.热的纯碱溶液去油污能力较强 |
| C.加催化剂使N2和H2在一定条件下转化为NH3 |
| D.常温下pH=3的H2SO4溶液中水的电离程度小于pH=3的NH4Cl溶液中水的电离程度 |
右图是向100mL的盐酸中逐滴加入NaOH溶液时,混合溶液的pH变化图像,根据图像得出的结论正确的是
| A.原盐酸溶液的浓度为0.1mol/L |
| B.加入的NaOH溶液的浓度为0.1mol/L |
| C.至滴定终点用去NaOH为0.01mo1 |
| D.pH=12时,共加入NaOH溶液100mL |
量取25.00mL硫酸溶液,可选用的仪器是
| A.50mL量筒 | B.25mL量筒 |
| C.50mL碱式滴定管 | D.50mL酸式滴定管 |
在一定条件下,0.2 mol下列气体分别与1 L 0.2 mol.L一1的NaOH溶液反应,形成的溶液pH最小的是
| A.SO3 | B.SO2 | C.NO2 | D.CO2 |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

| A.a点由水电离出的c(H+)=1.0×10-14mol·L-1 |
| B.b点:c(NH)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
常温下,体积、物质的量浓度均相等的四种溶液:①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
| A.将①与②分别稀释相同倍数后溶液的pH:①>② |
| B.③与④中已电离的水分子的数目相等 |
| C.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3·H2O) |
| D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
V mL密度为ρ g·mL-1的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶
质的质量分数为w%,物质的量浓度为c mol·L-1,那么下列关系式正确的是( )
A.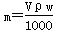 |
B.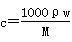 |
C.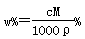 |
D.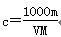 |