| A.Kw和Kc都随温度的升高而增大 | B.Kw和Kc数值不同,但单位相同 |
| C.Kw和Kc数值相同,但单位不同 | D.Kw和Kc数值和单位都不同 |
有关①100ml 0.1 mol/L  、②100ml 0.1 mol/L
、②100ml 0.1 mol/L  两种溶液的叙述不正确的是(
两种溶液的叙述不正确的是(
| A.①溶液中:c(CO32-)> c(H2CO3) | B.溶液中阴离子的物质的量浓度之和:②>① |
C.溶液中水电离出的 个数:②>① 个数:②>① |
D.②溶液中: c(HCO3-)> c(H2CO3) |
为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,AG=lg[c(H+)/c(OH-)].下列叙述中正确的是 ( )
①任何温度下,纯水的AG等于0; ②溶液的AG越小,酸性越强;
③常温下,0.1mol/L盐酸的AG=12; ④25℃时,某溶液的AG=-10,其pH=10.
| A.①③ | B.②④ | C.①② | D.③④ |
下列各种说法中,都包含有前后两个数值,其中前者大于后者的是( )
| A.在25℃和80℃时纯水中的c(H+)浓度 |
| B.室温时,浓度均为 0.1mol/L的(NH4)2SO4(aq)、(NH4) 2CO3 (aq)的c(NH4+) |
| C.25℃时,pH均为3的HCl和NH4Cl溶液中水的电离程度 |
| D.1 L饱和氯化铵溶液中NH4+和Cl- 的个数 |
回答下列各小题:
(1)已知 在水中的电离方程式为
在水中的电离方程式为 。在
。在 溶液
溶液 __________
__________ (填“>”“=”或“<”,1分)。
(填“>”“=”或“<”,1分)。
(2)常温下,向1.0mol/L的 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的 溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”,1分),c点所示的离子方程式为______________________________________________________。
溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”,1分),c点所示的离子方程式为______________________________________________________。
(3)在T℃时,将 晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将__________25℃(填“高于”或“低于”,1分),K
晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将__________25℃(填“高于”或“低于”,1分),K 为__________,在该溶液中由水电离出的
为__________,在该溶液中由水电离出的 为__________mol·L-1。T℃时,将pH=11的NaOH溶液V1L与pH=1的
为__________mol·L-1。T℃时,将pH=11的NaOH溶液V1L与pH=1的 溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________,此溶液中各种离子的浓度由大到小的排列顺序为________________________________________________。
溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________,此溶液中各种离子的浓度由大到小的排列顺序为________________________________________________。
(4)0.1 mol·L-1pH为4的NaHB溶液中① 、②
、② 、③
、③ 由大到小的顺序为_______________。
由大到小的顺序为_______________。
(5)在0.1 mol·L-1的① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液中,
溶液中, 由大到小的排列顺序为_______________________。
由大到小的排列顺序为_______________________。
莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定的基准物质,在1 L 0.1 mol/L的该盐溶液中,下列有关比较正确的是 ( )
| A.c(NH4+)+c(NH3·H2O) =" 0.1" mol/L |
| B.2c(Fe2+)+c(NH4+) = 2c(SO42-) |
| C.c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| D.c(NH4+)∶c(Fe2+)∶c(SO42-) = 2∶1∶2 |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 | B.水的离子积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 | D.水的离子积变大、pH变小、呈中性 |
下列事实不能用勒夏特利原理来解释的是
| A.增大压强,有利于SO2和O2反应生成SO3 |
| B.热的纯碱溶液去油污能力较强 |
| C.加催化剂使N2和H2在一定条件下转化为NH3 |
| D.常温下pH=3的H2SO4溶液中水的电离程度小于pH=3的NH4Cl溶液中水的电离程度 |
右图是向100mL的盐酸中逐滴加入NaOH溶液时,混合溶液的pH变化图像,根据图像得出的结论正确的是
| A.原盐酸溶液的浓度为0.1mol/L |
| B.加入的NaOH溶液的浓度为0.1mol/L |
| C.至滴定终点用去NaOH为0.01mo1 |
| D.pH=12时,共加入NaOH溶液100mL |
量取25.00mL硫酸溶液,可选用的仪器是
| A.50mL量筒 | B.25mL量筒 |
| C.50mL碱式滴定管 | D.50mL酸式滴定管 |
在一定条件下,0.2 mol下列气体分别与1 L 0.2 mol.L一1的NaOH溶液反应,形成的溶液pH最小的是
| A.SO3 | B.SO2 | C.NO2 | D.CO2 |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

| A.a点由水电离出的c(H+)=1.0×10-14mol·L-1 |
| B.b点:c(NH)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
常温下,体积、物质的量浓度均相等的四种溶液:①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
| A.将①与②分别稀释相同倍数后溶液的pH:①>② |
| B.③与④中已电离的水分子的数目相等 |
| C.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3·H2O) |
| D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
V mL密度为ρ g·mL-1的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶
质的质量分数为w%,物质的量浓度为c mol·L-1,那么下列关系式正确的是( )
A.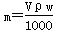 |
B.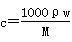 |
C.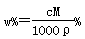 |
D.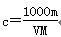 |