化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(e处反应的化学方程式为:2KMnO4+16HCl===2MnCl2+5Cl2↑+8H2O)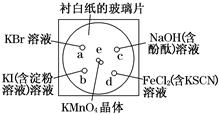
(1)e处反应中被氧化的HCl与参加反应的HCl的物质的量之比为 。
(2)b处的实验现象为___________________________________。
(3)c处反应的化学方程式为_____________________________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验比较Cl2、FeCl3、KMnO4三种物质氧化性由强到弱的顺序是 。
I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42- ;
4H++2Fe2++4SO42- ;
②Fe2++O2+H+ Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来
II、在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是_____________________________ 。在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是_______________________ _。(提示:碘元素被氧化成IO3—)从以上实验可知,ClO—、I2、IO3—的氧化性由强到弱的顺序是 。
III、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为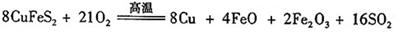
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
阅读下列材料后,回答相应问题。
一个体重50Kg的健康人大约含铁2g,这2g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1)人体中经常进行 的相互转化,在A过程中,Fe2+做 剂,在B过程中,Fe3+做 剂。
的相互转化,在A过程中,Fe2+做 剂,在B过程中,Fe3+做 剂。
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子。”这句话指出,维生素C在这一反应中做 _剂,具有 性。
(3)向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体,则其离子方程式为: 。
(4)为了验证Fe3+的性质,某化学兴趣小组设计了如下图所示的一组实验,其中实验结果一定错误的是 。(填字母)
| A.④和⑤ | B.只有③ | C.③和④ | D.①②③ |
(5)已知:氧化性Cl2> Br2> Fe3+, 还原性Fe2+>Br— >Cl—,则向0.2 mol·L—1 1L FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是 ,此反应的离子方程式: 。
(17分)(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO===Cu+H2O所属的区域。
② “四种基本反应类型与氧化还原反应的关系”也可用B图表达。其中Ⅰ为化合反应,则Ⅱ为 反应。写出有水生成的符合反应类型Ⅲ的一个化学方程式: 。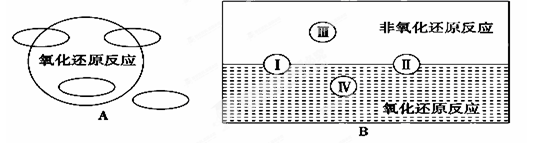
(2)已知反应:①SO3+H2O===H2SO4
②Cl2+H2O===HCl+HClO
③2F2+2H2O===4HF+O2
④2Na+2H2O===2NaOH+H2↑
⑤2Na2O2+2H2O===4NaOH+O2↑
⑥SiO2+2NaOH===Na2SiO3+H2O
上述反应中不属于氧化还原反应的有 (填序号,下同);H2O被氧化的是 ,H2O被还原的是 ,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是 。
(3)反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,Mn元素的化合价由 价变为 价,被 ; 元素的原子失去电子,被 ;若参加反应的HCl是73 g,则被氧化的HCl是 g。
(4)根据反应①2FeCl3+2KI===2FeCl2+2KCl+I2,
②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的( )
| A.Fe3+>Cl2>I2 | B.Cl2>I2>Fe3+ | C.I2>Cl2>Fe3+ | D.Cl2>Fe3+>I2 |
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去) 
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫原因 。
(4)D中干燥管中出现的现象及化学方程式 ; 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,该洗气装置中盛装 试剂。
(6)还有什么方法能证明氧化性Cl2 > S,用一种相关事实说明 。
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+ ,由此说明:
,由此说明:
(1)H2O2的氧化性比Fe3+ ,其还原性比Fe2+ (填“强”或“弱”) (2)
(2) 在H2O2分解过程中,FeSO4溶液 的作用是
在H2O2分解过程中,FeSO4溶液 的作用是
(1)写出下列反应的离子方程式:
①氯化铵溶液和氢氧化钠溶液反应 ;
②少量二氧化碳通入澄清石灰水 ;
③三氧化二铁和盐酸反应 。
(2)铜和浓硫酸发生反应的化学方程式为:Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作_________剂,具有 性。
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作_________剂,具有 性。
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是 ;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 7N2+12H2O
7N2+12H2O
①上述反应中被还原的元素是 (填元素符号),反应中每转移2.4mol电子,生成N2的物质的量为 。
②超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ、O3 O+O2
O+O2
Ⅱ、NO+O3 →NO2+O2
Ⅲ、 NO2+O→NO+O2
上述反应中NO所起的作用是 ;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
| 方法Ⅰ |
用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ |
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,写出该反应的离子方程式: ,是利用了SO2的 性质(选填字母编号)。
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物
为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)

实验过程:
Ⅰ.打开弹簧夹K1-K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,单后关闭K1、K2、K3 .
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅵ,检验B溶液中的离子.
(1)过程Ⅰ的目的是___________________________
(2)棉花中浸润的溶液为_______________________
(3)A中发生反应的化学方程式为_____________________________________________
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是___________________
(5)过程Ⅳ中检验B溶液中是否含有硫酸根的操作是______________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化Cl2>Fe3+>SO2的是
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
有反应:
①2H2O+Cl2+SO2====H2SO4+2HCl
②2KMnO4+16HCl====2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)两反应中的氧化剂的氧化性强弱顺序为 ,
还原剂的还原性强弱顺序为 。
(2)反应①中氧化产物和还原产物质量比为 。
I.某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2→O2。
(1) 该反应中的还原剂是________。
(2) 该反应中,发生还原反应的过程是________→________。
(3) 写出该反应的化学方程式,并标出电子转移的方向和数目:
_____________________ __ 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
II.高锰酸钾在不同的条件下发生的反应如下:
MnO +5e-+8H+===Mn2++4H2O ①
+5e-+8H+===Mn2++4H2O ①
MnO +3e-+2H2O===MnO2↓+4OH- ②
+3e-+2H2O===MnO2↓+4OH- ②
MnO +e-===MnO
+e-===MnO (溶液绿色) ③
(溶液绿色) ③
(1) 从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的________影响。
(2) 将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
__________→___________。
(3) 将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________
a. 氧化性:PbO2>KMnO4
b. 还原性:PbO2>KMnO4
c. 该反应可以用盐酸酸化
(4) 将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):
① ________KMnO4+________K2S+______( )===________K2MnO4+________K2SO4+________S↓+______( )。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为________。
已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200 mL混合溶液中含FeI2、FeBr2各0.10 mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其他反应)
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是________,剩余Fe2+的物质的量为________。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为________,若最终所得溶液为400 mL,其中主要阳离子及其物质的量浓度为________。
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是________________________。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式:_________________;上述所有反应共消耗Cl2________mol。
钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。
完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式 。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向_____________________。
(3)在20.00mL的0.1mol/L VO2+溶液中,加入 0.195g锌粉,恰好完成反应,则还原产物可能是__________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+____________。
)(1)2KClO3=2KCl+3O2↑ 是氧化剂, 是还原剂; 元素被氧化, 元素被还原; 是氧化产物, 是还原产物;并用双线桥法标出这个反应的电子转移方向和数目。
2KClO3=2KCl+3O2↑
(2)已知反应:
①MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
②Cl2+SO2+2H2O=H2SO4+2HCl
1)两反应中的氧化剂的氧化性强弱顺序为 ;
2)反应②中氧化剂与还原剂的物质的量之比为 ;
3)反应①的离子方程式 ;
4)用174kg MnO2通过①②两反应可以处理SO2的质量为 。